题目内容
【题目】火力发电厂释放出的大量NONOx、SO2、CO2会对环境造成污染。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现节能减排、废物利用等目的。
(1)脱硝:利用甲烷催化还原NOx;
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为_____________________________________。
(2)脱硫:①某种脱硫工艺将废气处理后可获得硫酸铵和硝酸铵,物质的量浓度相等的硫酸铵溶液和硝酸铵溶液,前者的c(NH4+)与后者的c(NH4+)的关系是__________。
A.大于2倍 B.等于2倍 C.介于2倍与2倍之间 D.小于1倍
②25℃时pH均为4的硝酸铵溶液和稀硝酸中由水电离出的氢离子浓度分别为c1、c2 ,则c1与c2的比值等于_______。
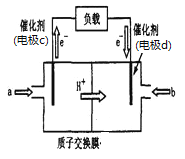
(2)脱碳:废气中的CO2转化为甲醇(CH3OH)可用于制作甲醇燃料电池(结构如图),质子交换膜左右两侧的溶液均为1L2mol·L-1H2SO4溶液.电极c上发生的电极反应式为____,当电池中有1mole-发生转移时左右两侧溶液的质量之差为___g (假设反应物a、b耗尽,忽略气体的溶解)。
【答案】CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ/mol
A 106 CH3OH+H2O-6e-=CO2↑+6H+ 12g
【解析】
试题分析:(1)根据盖斯定律计算;
(2)①铵根浓度越大水解程度越小;
②水解促进水的电离,酸抑制水的电离;
(3)负极反应式为CH3OH-6e-+H2O=CO2+6H+,正极反应式为O2+4H++4e-=2H2O,按照电极反应式计算。
解析:(1)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ·mol-1
根据盖斯定律可知(①+②)÷2即得到甲烷直接将NO2还原为N2的热化学方程式为即CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ/mol;
(2)①物质的量浓度相等的硫酸铵溶液和硝酸铵溶液,前者的水解程度小于后者,则前者c(NH4+)大于后者的c(NH4+)的2倍,答案选A。
②硝酸铵水解促进水的电离,c1=10-4 mol/L,稀醋酸抑制水的电离,c2=c(OH-)=1014
÷104=10-10 mol/L,因此则c1与c2的比值等于104/1010=106;
(3)根据电子流向可知电解c是负极,通入甲醇,负极反应式为 CH3OH+H2O-6e-=CO2↑+6H+;当转移1mol电子时,左侧质量减轻1/6×12g=2g,还要有1molH+通过质子交换膜进入右侧,质量减少1g,正极反应式为O2+4H++4e-=2H2O,右侧质量增加32g×1/4=8g,加上转移过来的1gH+,因此左右两侧溶液的质量之差为8g+1g+2g+1g=12g。



