题目内容
14.下列离子方程式书写正确的是( )| A. | 用Pt电极电解少量的MgCl2溶液:2H2O+2Cl-$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- | |
| B. | 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | |
| C. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| D. | 用食醋除去水瓶中的水垢:CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O |
分析 A.电解生成氢氧化镁、氢气、氯气;
B.发生氧化还原反应,生成硝酸铁、NO和水;
C.向NaAlO2溶液中通入过量CO2制Al(OH)3,还生成碳酸氢钠;
D.水垢的主要成分为碳酸钙,在离子反应中保留化学式.
解答 解:A.Pt电极电解少量的MgCl2溶液的离子反应为Mg2++2H2O+2Cl-$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+Mg(OH)2↓,故A错误;
B.向氢氧化亚铁中加入足量的稀硝酸的离子反应为3Fe(OH)2+NO3-+10H+═3Fe3++8H2O+NO↑,故B错误;
C.向NaAlO2溶液中通入过量CO2制Al(OH)3的离子反应为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故C正确;
D.水垢的主要成分为CaCO3,用食醋除去水瓶中的水垢的离子反应为CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O,故D错误;
故选C.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应及氧化还原反应、电解反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
4.元素周期表里金属元素和非金属元素分界线附近能找到( )
| A. | 新制农药元素 | B. | 制催化剂元素 | ||
| C. | 制半导体元素 | D. | 制耐高温合金元素 |
5.说法正确的是( )
| A. | 含有非极性键的分子一定是非极性分子 | |
| B. | 非极性分子中一定含有非极性键 | |
| C. | 由极性键形成的双原子分子一定是极性分子 | |
| D. | 键的极性与分子的极性无关 |
2.下列反应中,属于氧化还原反应同时又是吸热反应的是( )
| A. | 灼热的炭与CO2反应 | B. | 铝与稀盐酸反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl反应 | D. | 甲烷与O2的燃烧反应 |
9.食品和药品关系人的生存和健康.市场上销售的食盐品种很多.下列食盐中,所添加的元素不属于人体必需微量元素的是( )
| A. | 加锌盐 | B. | 加碘盐 | C. | 加钙盐 |
9.现有pH=5的CH3COOH溶液10mL,要使其pH增大3,可采取的方法有( )
| A. | 向溶液中加水稀释至10 L | B. | 加入一定量的NaOH固体 | ||
| C. | 加入一定量pH=8的NaOH溶液 | D. | 加入一定浓度的盐酸 |
 实验室中只有0.1000mol•L-1的酸性KMnO4溶液,甲同学用下图所示操作配制100mL0.0010mol•L-1的KMnO4溶液,指出其中的两处错误称取酸性高锰酸钾选用碱式滴定管、在容量瓶稀释浓溶液.
实验室中只有0.1000mol•L-1的酸性KMnO4溶液,甲同学用下图所示操作配制100mL0.0010mol•L-1的KMnO4溶液,指出其中的两处错误称取酸性高锰酸钾选用碱式滴定管、在容量瓶稀释浓溶液.
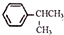 可写成
可写成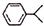
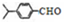 ,上述合成路线中①属于加成反应;
,上述合成路线中①属于加成反应;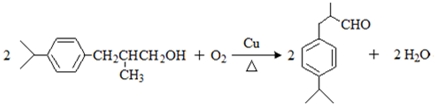 .
.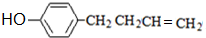 .
.