题目内容
(12分)(1)已知C(s、金刚石)+O2==CO2(g) ΔH=-395.4kJ/mol,
C(s、石墨)+O2==CO2(g) ΔH=-393.5kJ/mol。
①石墨和金刚石相比,石墨的稳定性 金刚石的稳定性。
②石墨中C-C键键能______金刚石中C-C键键能。(均填“大于”、“小于”或“等于”)。
(2)肼(N2H4)和NO2是一种双组分火箭推进剂。两物质混合发生反应生成N2和H2O(g),已知8g气体肼在上述反应中放出142kJ热量,其热化学方程式为: 。
(3)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学反应方程式为: ;
又知H2O(l) H2O(g),△H=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是 kJ。
H2O(g),△H=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是 kJ。
(1)大于; 大于。
(2)2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1136kJ/mol
(3)B2H6(g)+3O2(g)=B2O3(s)+3H2O(l);△H=-2165kJ/mol 1016.5kJ
【解析】
试题分析:(1)①通过分析已知热化学方程式可知,金刚石所含能量高,能量越低越稳定,所以石墨比较稳定;②△H=反应物键能-生成物键能,两反应中只要石墨和金刚石不同,从△H的值可分析出,石墨的键能大;(2)8gN2H4的物质的量为 =0.25mol,则1molN2H4反应放出的热量为
=0.25mol,则1molN2H4反应放出的热量为 ×142KJ=568KJ,其热化学方程式为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1136KL/mol;(3)0.3mol的气态乙硼烷燃烧放出的热量为649.5KJ,则1mol气态乙硼烷燃烧放出的热量为
×142KJ=568KJ,其热化学方程式为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1136KL/mol;(3)0.3mol的气态乙硼烷燃烧放出的热量为649.5KJ,则1mol气态乙硼烷燃烧放出的热量为 ×649.5KJ=2165KJ,则其热化学方程式为:B2H6(g)+3O2(g)=B2O3(g)+3H2O(l) △H=-2165KJ/mol;标准状况下11.2L乙硼烷为0.5mol,完全燃烧生成1.5mol液态水放热2165KJ÷2=1082.5KJ,又知H2O(l)?H2O(g) △H=+44kJ/mol,则1.5mol液态水变为水蒸气需吸热1.5mol×44KJ/mol=66KJ,则放热1082.5KJ-66KJ=1016.5KJ。
×649.5KJ=2165KJ,则其热化学方程式为:B2H6(g)+3O2(g)=B2O3(g)+3H2O(l) △H=-2165KJ/mol;标准状况下11.2L乙硼烷为0.5mol,完全燃烧生成1.5mol液态水放热2165KJ÷2=1082.5KJ,又知H2O(l)?H2O(g) △H=+44kJ/mol,则1.5mol液态水变为水蒸气需吸热1.5mol×44KJ/mol=66KJ,则放热1082.5KJ-66KJ=1016.5KJ。
考点:考查反应热和焓变。

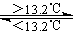 Sn(s、白) △H3=+2.1kJ·mol-1
Sn(s、白) △H3=+2.1kJ·mol-1