题目内容
6.写出甲烷与氯气反应的有机产物的结构简式CH3Cl、CH2Cl2、CHCl3、CCl4,写出一种乙烷的同系物CH4.分析 甲烷与氯气在光照条件下发生取代反应,甲烷中四个氢原子可以逐步被氯原子取代,生成有机物有CH3Cl、CH2Cl2、CHCl3、CCl4;
结构相似,在分子组成上相差一个或若干个CH2原子团的化合物互称同系物,据此分析.
解答 解:甲烷与氯气在光照条件下发生取代反应,甲烷中四个氢原子可以逐步被氯原子取代,故生成有机物有一氯甲烷CH3Cl、二氯甲烷CH2Cl2、三氯甲烷CHCl3和四氯化碳CCl4;
结构相似,在分子组成上相差一个或若干个CH2原子团的化合物互称同系物,故乙烷的同系物必须是同属于烷烃的化合物,如甲烷CH4.
故答案为:CH3Cl、CH2Cl2、CHCl3、CCl4;CH4.
点评 本题考查了甲烷的取代反应的产物和同系物的概念以及书写和判断,难度不大,注意基础的把握.

练习册系列答案
相关题目
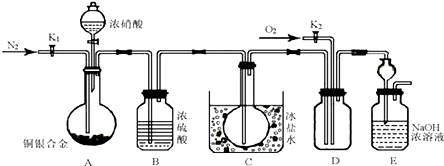
16.磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池的电极材料.某化工厂以铁红、锂辉石LiAl(SiO3)2(含少量Ca2+、Mg2+的盐)、碳粉等原料来生产磷酸亚铁锂.其主要工艺流程如图:

已知:2LiAl(SiO3)2+H2SO4(浓)$\frac{\underline{\;250~300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓
(1)从滤渣Ⅰ中可分离出Al2O3,如下图所示.请写出生成沉淀的离子方程式Al3++3NH3•H2O=Al(OH)3↓+3NH4+.

(2)滤渣Ⅱ的主要成分是:Mg(OH)2、CaCO3(填化学式).
(3)向滤液Ⅱ中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失.
(4)写出在高温下生成磷酸亚铁锂的化学方程式2FePO4+Li2CO3+2C$\frac{\underline{\;高温\;}}{\;}$2LiFePO4+3CO↑.

已知:2LiAl(SiO3)2+H2SO4(浓)$\frac{\underline{\;250~300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓
| 温度/℃ | 20 | 40 | 60 | 80 |
| 溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| 溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |

(2)滤渣Ⅱ的主要成分是:Mg(OH)2、CaCO3(填化学式).
(3)向滤液Ⅱ中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失.
(4)写出在高温下生成磷酸亚铁锂的化学方程式2FePO4+Li2CO3+2C$\frac{\underline{\;高温\;}}{\;}$2LiFePO4+3CO↑.
11.某同学进行试验探究时,欲配制1.0mol•L-1Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2•8H2O试剂(化学式量:315).在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物.为探究原因,该同学查得Ba(OH)2•8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6.
(1)烧杯中未溶物仅为BaCO3,理由是Ba(OH)2•8H2O与CO2作用转化为BaCO3
(2)假设试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,设计试验方案,进行成分检验,在答题卡上写出实验步骤、预期现象和结论.(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
(3)将试剂初步提纯后,准确测定其中Ba(OH)2•8H2O的含量.实验如下:
①配制250ml 约0.1mol•L-1Ba(OH)2•8H2O溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水,溶解、过滤,将溶液转入250mL容量瓶,洗涤,定容,摇匀.
②滴定:准确量取25.00ml所配制Ba(OH)2溶液于锥形瓶中,滴加指示剂,将
0.1980 (填“0.020”、“0.05”、“0.1980”或“1.5”)mol•L-1盐酸装入50ml酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗盐酸Vml.
(4)室温下,不能(填“能”或“不能”) 配制1.0mol•L-1Ba(OH)2溶液.
(1)烧杯中未溶物仅为BaCO3,理由是Ba(OH)2•8H2O与CO2作用转化为BaCO3
(2)假设试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,设计试验方案,进行成分检验,在答题卡上写出实验步骤、预期现象和结论.(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. |  |
| 步骤2:取适量滤液于试管中,滴加稀硫酸. | 有白色沉淀生成,说明有Ba2+; |
| 步骤3:取适量步骤1中的沉淀于是试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中 | 试管中有气泡生成,烧杯中的澄清石灰水变浑浊,结合步骤2说明沉淀是BaCO3 |
| 步骤4:取适量滤液于烧杯中,用pH计测其pH值 | pH>9.6,说明有大量的OH-,综合上面步骤可知试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,假设成立. |
①配制250ml 约0.1mol•L-1Ba(OH)2•8H2O溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水,溶解、过滤,将溶液转入250mL容量瓶,洗涤,定容,摇匀.
②滴定:准确量取25.00ml所配制Ba(OH)2溶液于锥形瓶中,滴加指示剂,将
0.1980 (填“0.020”、“0.05”、“0.1980”或“1.5”)mol•L-1盐酸装入50ml酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗盐酸Vml.
(4)室温下,不能(填“能”或“不能”) 配制1.0mol•L-1Ba(OH)2溶液.
15.下列说法不正确的是( )
| A. | 要想使AlCl3溶液中的Al3+几乎全部沉淀出来,可以加入过量的氨水 | |
| B. | 向FeCl2溶液中加入氨水,最终会看到红褐色沉淀 | |
| C. | 漂白粉的有效成分是次氯酸钙 | |
| D. | 氢氧化钠、纯碱溶液要存放在带磨砂玻璃塞的试剂瓶中 |
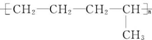 的单体是CH2═CH-CH3、CH2═CH2;(写结构简式)
的单体是CH2═CH-CH3、CH2═CH2;(写结构简式)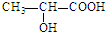 )中的官能团名称是:羟基、羧基;两分子乳酸在浓硫酸加热的条件下,可生成一种环状酯,写出此酯的结构简式:
)中的官能团名称是:羟基、羧基;两分子乳酸在浓硫酸加热的条件下,可生成一种环状酯,写出此酯的结构简式: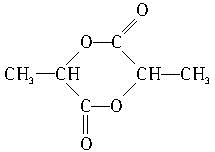 ;
;