题目内容
7.NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 23gNa变为Na+时失去的电子数为NA | |
| B. | 18g水所含的电子数为NA | |
| C. | 8g He所含的分子数为NA | |
| D. | 16g O2与16g O3所含的原子数均是NA |
分析 A.1个钠原子失去1个电子变为钠离子;
B.1个水分子含有10个电子;
C.氦气为氮原子分子;
D.氧气和臭氧都是由氧原子构成.
解答 解:A.23gNa物质的量为1mol,变为Na+时失去的电子数为NA,故A正确;
B.18g水分子物质的量为1mol,含有电子数为10NA,故B错误;
C.He的物质的量为n=$\frac{8g}{4g/mol}$=2mol,所含的分子数为2NA,故C错误;
D.依据n=$\frac{m}{M}$=$\frac{16g}{16g/mol}$=1mol,可知16g O2与16g O3所含的原子的物质的量都是1mol,含有原子个数都是:NA,故D正确;
故选:AD.
点评 本题考查了阿伏伽德罗常数的有关问题,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系是解题关键,题目难度不大.

练习册系列答案
相关题目
15.类推的思想方式在化学学习与研究中经常被采用,但类推出的结论是否正确最终要经过实验的验证.以下类推的结论中正确的是( )
| A. | SO2能使酸性KMnO4溶液褪色,故CO2也能使酸性KMnO4溶液褪色 | |
| B. | Mg与CuSO4反应置换出Cu,故Na与CuSO4反应也可以置换出Cu | |
| C. | 次氯酸可以令有色布条褪色,因其强氧化性,故过氧化钠也可以令有色布条褪色 | |
| D. | SO2能使品红溶液褪色,故CO2也能使品红溶液褪色 |
2.环境监测中心在公布城市空气质量报告时,不需要公布指标的项目是( )
| A. | 二氧化碳 | B. | 二氧化硫 | C. | 氮氧化物 | D. | 可吸入颗粒物 |
12.下列化学实验基本操作中正确的是( )
| A. | 分液时,碘的四氯化碳溶液从分液漏斗下口放出,水层从上口倒出 | |
| B. | 蒸馏时,水从冷凝管上部通入,从下部流出 | |
| C. | 向某溶液中加入AgNO3溶液,生成白色沉淀,该溶液中一定含有Cl- | |
| D. | 称量时,将纯碱放在称量纸上置于托盘天平的右盘,将砝码放在托盘天平的左盘 |
19.下列物质放置在空气中,因发生氧化还原而变质的是( )
| A. | Na2CO3 | B. | NaOH | C. | NaCl | D. | Na |
 ,
,
 的同分异构体:
的同分异构体: 、
、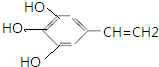 .
. 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题: