题目内容
如图1为元素周期表的一部分.请回答下列问题:
(1)上述元素中,属于s区的是 (填元素符号).
(2)元素第一电离能为⑤ ⑥(填“大于”或“小于”).
(3)③气态氢化物的中心原子有 对弧对电子,其VSEPR模型为 ;中心原子的杂化类型为 ;该分子为 分子(填“极性”或“非极性”).
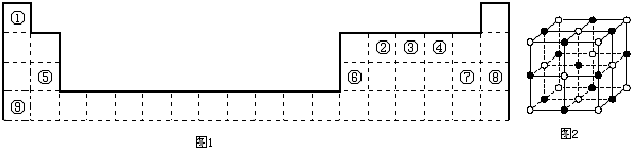
(4)元素⑦的钠盐晶胞结构如图2所示,每个Na+周围与之距离最近的Na+的个数为 .
(5)第四周期元素中,基态原子最外层电子数与⑨相同的元素共有 种(包括⑨).
(1)上述元素中,属于s区的是
(2)元素第一电离能为⑤
(3)③气态氢化物的中心原子有
(4)元素⑦的钠盐晶胞结构如图2所示,每个Na+周围与之距离最近的Na+的个数为
(5)第四周期元素中,基态原子最外层电子数与⑨相同的元素共有

考点:晶胞的计算,元素周期表的结构及其应用,位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:由元素的位置可知,①为H,②为C,③为N,④为O,⑤为Mg,⑥为Al,⑦为Cl,⑧为Ar,⑨为K,
(1)按电子排布,最后填入电子的能级为s能级,为s区,在元素周期表中包括第ⅠA族、第ⅡA族;
(2)同周期中,Mg的3s电子全满为稳定结构;
(3)元素③气态氢化物为NH3,N原子价层电子对为4,杂化轨道数为4;
判断ABn型分子极性经验规律:若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子;若不等,则为极性分子.
(4)元素⑦的钠盐为NaCl,根据晶胞结构可知Na+周围与之距离最近的Na+处于对角线上;
(5)第四周期元素中,基态原子最外层电子数与⑨相同,即最外层电子数为1.
(1)按电子排布,最后填入电子的能级为s能级,为s区,在元素周期表中包括第ⅠA族、第ⅡA族;
(2)同周期中,Mg的3s电子全满为稳定结构;
(3)元素③气态氢化物为NH3,N原子价层电子对为4,杂化轨道数为4;
判断ABn型分子极性经验规律:若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子;若不等,则为极性分子.
(4)元素⑦的钠盐为NaCl,根据晶胞结构可知Na+周围与之距离最近的Na+处于对角线上;
(5)第四周期元素中,基态原子最外层电子数与⑨相同,即最外层电子数为1.
解答:
解:由元素的位置可知,①为H,②为C,③为N,④为O,⑤为Mg,⑥为Al,⑦为Cl,⑧为Ar,⑨为K,
(1)按电子排布,最后填入电子的能级为s能级,为s区,在元素周期表中包括第ⅠA族、第ⅡA族,则H、Mg、K符合,故答案为:H、Mg、K;
(2)同周期中,Mg的3s电子全满为稳定结构,则元素第一电离能为⑤大于⑥,故答案为:大于;
(3)元素③为N元素,其气态氢化物为NH3,电子式为 ,中心原子有1对孤对电子,N原子价层电子对为4,其VSEPR模型为正四面体;N原子的杂化轨道数为4,所以N原子采取sp3杂化;NH3空间结构不对称,N元素化合价绝对值大于3,故NH3是极性分子,
,中心原子有1对孤对电子,N原子价层电子对为4,其VSEPR模型为正四面体;N原子的杂化轨道数为4,所以N原子采取sp3杂化;NH3空间结构不对称,N元素化合价绝对值大于3,故NH3是极性分子,
故答案为:1;四面体;sp3;极性;
(4)元素⑦为氯元素,其钠盐为NaCl,在氯化钠晶胞中若以黑色球为钠离子,白色球为氯离子,以中心的黑色球钠离子分析,Na+周围与之距离最近的Na+处于对角线上,故有12个,故答案为:12;
(5)第四周期元素中,基态原子最外层电子数与⑨相同,即最外层电子数为1,则Cr、Cu符合,包括K共符合,故答案为:3.
(1)按电子排布,最后填入电子的能级为s能级,为s区,在元素周期表中包括第ⅠA族、第ⅡA族,则H、Mg、K符合,故答案为:H、Mg、K;
(2)同周期中,Mg的3s电子全满为稳定结构,则元素第一电离能为⑤大于⑥,故答案为:大于;
(3)元素③为N元素,其气态氢化物为NH3,电子式为
 ,中心原子有1对孤对电子,N原子价层电子对为4,其VSEPR模型为正四面体;N原子的杂化轨道数为4,所以N原子采取sp3杂化;NH3空间结构不对称,N元素化合价绝对值大于3,故NH3是极性分子,
,中心原子有1对孤对电子,N原子价层电子对为4,其VSEPR模型为正四面体;N原子的杂化轨道数为4,所以N原子采取sp3杂化;NH3空间结构不对称,N元素化合价绝对值大于3,故NH3是极性分子,故答案为:1;四面体;sp3;极性;
(4)元素⑦为氯元素,其钠盐为NaCl,在氯化钠晶胞中若以黑色球为钠离子,白色球为氯离子,以中心的黑色球钠离子分析,Na+周围与之距离最近的Na+处于对角线上,故有12个,故答案为:12;
(5)第四周期元素中,基态原子最外层电子数与⑨相同,即最外层电子数为1,则Cr、Cu符合,包括K共符合,故答案为:3.
点评:本题考查位置、结构与性质的综合应用,为高频考点,把握元素周期表的结构、元素的位置及原子结构知识为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
现有一种碳酸钠晶体(Na2CO3?nH2O)样品,可采用在不同温度下加热样品(温度逐渐升高)来测定其组成.学生测定结果n值偏小,其可能的原因为( )
| A、温度过高致少量碳酸钠分解了 |
| B、碳酸钠晶体样品已有少量风化 |
| C、样品加热后放在干燥器中进行冷却 |
| D、加热过程中有少量晶体溅出 |
实验室中,有关试剂的保存方法错误的是( )
| A、浓硝酸保存在棕色细口瓶中 |
| B、液溴用水封保存 |
| C、少量金属钠保存在煤油中 |
| D、烧碱溶液保存在带玻璃塞的试剂瓶中 |
历史上最早应用的还原性染料是靛蓝,其结构简式如图所示,下列关于靛蓝的叙述中错误的是( )

| A、靛蓝由碳、氢、氧、氮四种元素组成 |
| B、它的分子式是C16H10N2O2 |
| C、它是芳香族有机物 |
| D、该物质是高分子化合物 |

 (1)如图1所示装置,在平底烧瓶的底部有一块钠,平底烧瓶内是干燥的空气.过一段时间后可观察到
(1)如图1所示装置,在平底烧瓶的底部有一块钠,平底烧瓶内是干燥的空气.过一段时间后可观察到 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: