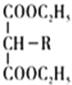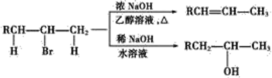题目内容
【题目】亚硝酸钠![]() 是一种工业盐,外观与食盐相似。下面是某学习小组设计的
是一种工业盐,外观与食盐相似。下面是某学习小组设计的![]() 制取实验和纯度检验实验。该小组收集了相关资料:
制取实验和纯度检验实验。该小组收集了相关资料:
![]() 和
和![]() 溶液反应生成
溶液反应生成![]() 和
和![]() 为淡黄色接近白色固体,在水中形成沉淀
为淡黄色接近白色固体,在水中形成沉淀![]()
Ⅰ![]() 亚硝酸钠的制取实验
亚硝酸钠的制取实验
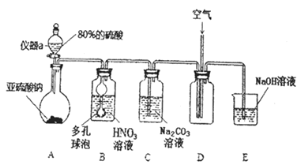
![]() 仪器a的名称为___________,A装置中发生的化学反应方程式为________________。
仪器a的名称为___________,A装置中发生的化学反应方程式为________________。
![]() 装置中多孔球泡的作用_________________________。
装置中多孔球泡的作用_________________________。
![]() 若装置B中逸出的NO与
若装置B中逸出的NO与![]() 气体物质的量之比为
气体物质的量之比为![]() ,则装置B中发生反应的化学方程式为_______。
,则装置B中发生反应的化学方程式为_______。
![]() 实验过程中需控制C装置中溶液
实验过程中需控制C装置中溶液![]() ,否则C中生成的
,否则C中生成的![]() 的产量会下降,理由是_______________。
的产量会下降,理由是_______________。
![]() 请根据题干所给信息设计实验证明C装置中有
请根据题干所给信息设计实验证明C装置中有![]() 产生:__________。
产生:__________。 ![]() 限选用的试剂:稀硝酸、硝酸银溶液、NaOH溶液
限选用的试剂:稀硝酸、硝酸银溶液、NaOH溶液![]()
Ⅱ![]() 亚硝酸钠的纯度检验
亚硝酸钠的纯度检验
已知:![]()
![]()
![]()
![]()
![]()
![]() 反应结束后C中溶液通过结晶获得
反应结束后C中溶液通过结晶获得![]() 粗产品mg,溶解后稀释至250mL,分别取
粗产品mg,溶解后稀释至250mL,分别取![]() 用
用![]() 的酸性
的酸性![]() 溶液平行滴定三次,平均每次消耗酸性
溶液平行滴定三次,平均每次消耗酸性![]() 溶液的体积为VmL。则粗产品中
溶液的体积为VmL。则粗产品中![]() 的质量分数为_______
的质量分数为_______![]() 用含c、V、m的式子表示
用含c、V、m的式子表示![]() 。
。
【答案】分液漏斗 ![]() 浓
浓![]() 增大气体与溶液的接触面积,让反应充分进行
增大气体与溶液的接触面积,让反应充分进行 ![]() 如果
如果![]() ,亚硝酸盐会转化为硝酸盐和NO气体,使其产量下降 取C中溶液少量于试管中,加足量稀硝酸有气体生成,遇空气变红棕色,则证明C中有
,亚硝酸盐会转化为硝酸盐和NO气体,使其产量下降 取C中溶液少量于试管中,加足量稀硝酸有气体生成,遇空气变红棕色,则证明C中有![]() 生成
生成 ![]() 。
。
【解析】
Ⅰ![]() 仪器a的名称为分液漏斗,A装置中硫酸与亚硫酸钠发生强酸制弱酸的反应生成
仪器a的名称为分液漏斗,A装置中硫酸与亚硫酸钠发生强酸制弱酸的反应生成![]() 。
。
![]() 利用B装置中的多孔球泡可增大
利用B装置中的多孔球泡可增大![]() 气体与溶液的接触面积。
气体与溶液的接触面积。
![]() 装置B中逸出的NO与
装置B中逸出的NO与![]() 的物质的量之比为2:1,假设生成2molNO和
的物质的量之比为2:1,假设生成2molNO和![]() ,共转移
,共转移![]() ,则被氧化的
,则被氧化的![]() 的物质的量为
的物质的量为![]() ,从而得出反应中SO2、NO、NO2物质的量之比为7:4:2,利用此关系可写出反应的方程式。
,从而得出反应中SO2、NO、NO2物质的量之比为7:4:2,利用此关系可写出反应的方程式。
![]() 实验过程中,需控制C中溶液的
实验过程中,需控制C中溶液的![]() ,否则产率会下降,理由是如果
,否则产率会下降,理由是如果![]() ,
,![]() 。
。
(5)取C中溶液少量于试管中,加足量稀硝酸有气体生成,遇空气变红棕色,则证明C中有![]() 生成;
生成;
Ⅱ![]() 设NO2-的物质的量为n
设NO2-的物质的量为n
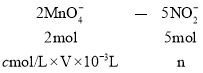
则:n=2.5cV×10-3mol
250mL溶液中所含物的量![]() ,
,
则粗产品中![]() 的质量分数
的质量分数![]() 。
。
Ⅰ![]() 仪器a的名称为分液漏斗,A装置中硫酸与亚硫酸钠发生强酸制弱酸生成
仪器a的名称为分液漏斗,A装置中硫酸与亚硫酸钠发生强酸制弱酸生成![]() ,化学方程式为:
,化学方程式为:![]()
![]() 浓
浓![]() ,
,
故答案为:分液漏斗;![]()
![]() 浓
浓![]() ;
;
![]() 利用B装置中的多孔球泡可增大
利用B装置中的多孔球泡可增大![]() 气体与溶液的接触面积,让反应充分进行,
气体与溶液的接触面积,让反应充分进行,
故答案为:增大气体与溶液的接触面积,让反应充分进行;
![]() 装置B中逸出的NO与
装置B中逸出的NO与![]() 的物质的量之比为2:1,假设生成2molNO和
的物质的量之比为2:1,假设生成2molNO和![]() ,共转移
,共转移![]() ,则被氧化的
,则被氧化的![]() 的物质的量为
的物质的量为![]() ,故装置B中发生反应的化学方程式为
,故装置B中发生反应的化学方程式为![]() ,
,
故答案为:![]() ;
;
![]() 实验过程中,需控制C中溶液的
实验过程中,需控制C中溶液的![]() ,否则产率会下降,理由是如果
,否则产率会下降,理由是如果![]() ,
,![]() ,亚硝酸盐会转化为硝酸盐和NO气体,
,亚硝酸盐会转化为硝酸盐和NO气体,
故答案为:如果![]() ,亚硝酸盐会转化为硝酸盐和NO气体,使其产量下降;
,亚硝酸盐会转化为硝酸盐和NO气体,使其产量下降;
![]() 已知
已知![]() ,
,![]() ,设计实验方案:取C中溶液少量于试管中,加足量稀硝酸有气体生成,遇空气变红棕色,则证明C中有
,设计实验方案:取C中溶液少量于试管中,加足量稀硝酸有气体生成,遇空气变红棕色,则证明C中有![]() 生成;
生成;
故答案为:取C中溶液少量于试管中,加足量稀硝酸有气体生成,遇空气变红棕色,则证明C中有![]() 生成;
生成;
Ⅱ![]() 设NO2-的物质的量为n
设NO2-的物质的量为n
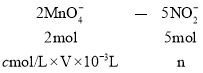
则:n=2.5cV×10-3mol
250mL溶液中所含物质的量![]() ,
,
则粗产品中![]() 的质量分数
的质量分数![]() ,
,
故答案为:![]() 。
。

 名校课堂系列答案
名校课堂系列答案