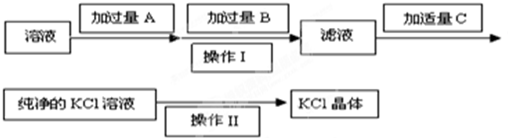
题目内容
12.下列叙述不正确的是( )| A. | 热化学方程式中的化学计量数表示物质的量,可以是分数 | |
| B. | 应用盖斯定律可计算某些难以直接测量的反应焓变 | |
| C. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| D. | 已知2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol,则氢气的燃烧热为285.8kJ/mol |
分析 A、热化学方程式的化学计量数表示物质的量,不表示分子个数;
B、CO燃烧的反应难以实现,可以通过C燃烧生成二氧化碳的焓变和CO燃烧生成二氧化碳的焓变利用盖斯定律求CO燃烧的焓变;
C、能量越低越稳定;
D、燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,根据燃烧热的定义判断热化学方程式是否正确.
解答 解:A、热化学方程式的化学计量数表示物质的量,可以是整数也可以是分数,故A正确;
B、CO燃烧的反应难以实现,可以通过C燃烧生成二氧化碳的焓变和CO燃烧生成二氧化碳的焓变利用盖斯定律求CO燃烧的焓变,故B正确;
C、C(石墨,s)═C(金刚石,s)△H>0,则金刚石能量高,则石墨稳定,故C错误;
D、由2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ/mol,可知1mol氢气完全燃烧生成稳定的氧化物放出的热量为285.8KJ,所以氢气的燃烧热△H=-285.8 kJ/mol,故D正确;
故选:C.
点评 本题虽难度不大,但考查范围广,考查知识基础、全面,是一道好题.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
20.下列有关粒子的表示方法正确的是( )
| A. | 氨气分子的电子式: | B. | 硫原子结构示意图: | ||
| C. | 氯气分子的结构式:Cl-Cl | D. | H2O2的电子式: |
17.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 粗铜板作阳极,电解硫酸铜溶液 | 粗铜溶解,纯铜在阴极上析出 | Cu 放电是氧化剂 |
| B | 向银氨溶液中滴加几滴乙醛后 水浴加热 | 银附着在试管壁上 | 乙醛发生还原反 应 |
| C | 向含 I-的无色溶液中滴加少量 新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
| D | 向 FeSO4溶液中先滴入 KSCN 溶液再滴加 H2O2 溶液 | 加入 H2O2后溶液变成血红色 | Fe2+既有氧化性又 有还原性 |
| A. | A | B. | B | C. | C | D. | D |
4.下列说法正确的是( )
| A. | 某物质经测定,只含有一种组成元素,则该物质一定是单质 | |
| B. | 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 | |
| C. | 碱性氧化物均是金属氧化物,酸性氧化物均是非金属氧化物 | |
| D. | 纯净的硫酸是纯净物,而纯净的盐酸是混合物 |
2.三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物.探究过程如下:
【查阅资料】:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,Cu2O在空气中加热生成CuO
【提出假设】
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
【设计探究实验】
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是固体完全溶解,溶液变为血红色.
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?不合理.
(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是Fe2O3和Cu2O的混合物,写出发生反应的离子方程式Cu2O+2H+═Cu+Cu2++H2O、2Fe3++Cu═2Fe2++Cu2+.
探究延伸
经实验分析确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为$\frac{9(b-a)}{a}$×100%.
(5)欲利用红色粉末Fe2O3和Cu2O的混合物制取较纯净的胆矾 (CuSO4.5H2O)经查阅资料得知,在溶液中调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH
实验室有下列试剂可供选择:
A.氯水 B.H2O2 C.硝酸 D.NaOH E.氨水 F.Cu2(OH)2CO3
实验小组设计如下实验方案:

试回答:①试剂I为B,试剂II为F(填字母).
②固体X的化学式为Fe(OH)3.
【查阅资料】:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,Cu2O在空气中加热生成CuO
【提出假设】
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
【设计探究实验】
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是固体完全溶解,溶液变为血红色.
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?不合理.
(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是Fe2O3和Cu2O的混合物,写出发生反应的离子方程式Cu2O+2H+═Cu+Cu2++H2O、2Fe3++Cu═2Fe2++Cu2+.
探究延伸
经实验分析确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为$\frac{9(b-a)}{a}$×100%.
(5)欲利用红色粉末Fe2O3和Cu2O的混合物制取较纯净的胆矾 (CuSO4.5H2O)经查阅资料得知,在溶液中调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
A.氯水 B.H2O2 C.硝酸 D.NaOH E.氨水 F.Cu2(OH)2CO3
实验小组设计如下实验方案:

试回答:①试剂I为B,试剂II为F(填字母).
②固体X的化学式为Fe(OH)3.
 .
.
 .
.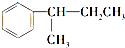 $\stackrel{酸性KMnO_{4}溶液}{→}$
$\stackrel{酸性KMnO_{4}溶液}{→}$ .
.