题目内容
(1)NaOH的摩尔质量是
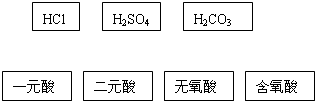
(2)根据交叉分类法,请用直线将下面的酸与酸的分类连接起来还可以补充的酸的分类标准有(只填一种):
40g/mol
40g/mol
.将4gNaOH溶于水配制成100mL溶液,所得溶液中NaOH的物质的量浓度是1mol/L
1mol/L
.取出10mL上述溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度是0.1mol/L
0.1mol/L
.(2)根据交叉分类法,请用直线将下面的酸与酸的分类连接起来还可以补充的酸的分类标准有(只填一种):
酸性强弱(或沸点高低)
酸性强弱(或沸点高低)
,从而将酸分成强酸、弱酸(或难挥发性酸、挥发性酸)
强酸、弱酸(或难挥发性酸、挥发性酸)
.
分析:(1)摩尔质量在数值上等于物质的相对分子质量,根据n=
=c×V计算相关量,根据溶液稀释前后溶质的物质的量不变计算稀释后的浓度;
(2)HCl为一元酸、无氧酸,硫酸和碳酸都属于二元酸和含氧酸,其中盐酸和硫酸为强酸,碳酸为弱酸,并且硫酸沸点高,难挥发,以此分类.
| m |
| M |
(2)HCl为一元酸、无氧酸,硫酸和碳酸都属于二元酸和含氧酸,其中盐酸和硫酸为强酸,碳酸为弱酸,并且硫酸沸点高,难挥发,以此分类.
解答:解:(1)NaOH的摩尔质量在数值上等于NaOH的相对分子质量,为40g/mol,
n(NaOH)=
=0.1mol,c(NaOH)=
=1mol/L,
取出10mL上述溶液,n(NaOH)=1mol/L×0.01L=0.01mol,
加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度是
=0.1mol/L,
故答案为:40g/mol;1mol/L;0.1mol/L;
(2)HCl为一元酸、无氧酸,硫酸和碳酸都属于二元酸和含氧酸,用交叉法分类为:
 ,
,
其中盐酸和硫酸为强酸,碳酸为弱酸,并且硫酸沸点高,难挥发,
所以还可以按照酸性强弱或沸点高低分类,
故答案为: ;
;
酸性强弱(或沸点高低),强酸、弱酸(或难挥发性酸、挥发性酸).
n(NaOH)=
| 4g |
| 40g/mol |
| 0.1mol |
| 0.1L |
取出10mL上述溶液,n(NaOH)=1mol/L×0.01L=0.01mol,
加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度是
| 0.01mol |
| 0.1L |
故答案为:40g/mol;1mol/L;0.1mol/L;
(2)HCl为一元酸、无氧酸,硫酸和碳酸都属于二元酸和含氧酸,用交叉法分类为:
 ,
,其中盐酸和硫酸为强酸,碳酸为弱酸,并且硫酸沸点高,难挥发,
所以还可以按照酸性强弱或沸点高低分类,
故答案为:
 ;
;酸性强弱(或沸点高低),强酸、弱酸(或难挥发性酸、挥发性酸).
点评:本题考查溶液的物质的量浓度的计算以及物质的分类,题目难度不大,注意物质的分类标准和物质的性质.

练习册系列答案
相关题目
 溶液中NaOH的物质的量浓度是 。
溶液中NaOH的物质的量浓度是 。


