题目内容
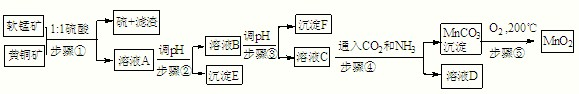
已知KMnO4、MnO2在酸性条件下将草酸钠(Na2C2O4)氧化,离子反应为:
2MnO4—+5C2O42—+16H+==2Mn2++10CO2↑+8H2O
MnO2+C2O42—+4H+==Mn2++2CO2↑+2H2O
为测定某软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品,加入2.68g无水草酸钠固体,再加入足量的稀硫酸(杂质不反应),充分反应后将所得溶液转移到250mL容量瓶中,用蒸馏水稀释至刻度,摇匀后从中取出25.00mL,再用0.02mol/LKMnO4溶液滴定.当滴入20.00mLKMnO4溶液时恰好完全反应.求该软锰矿中MnO2的质量分数.
答案:72.5%

练习册系列答案
相关题目
活性氧化锌常用作橡胶制品的硫化活性剂.工业上用粗氧化锌(含少量CuO、FeO、MnO、Fe2O3等)生产活性氧化锌,生产工艺流程如下:
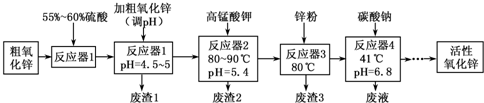
根据上表提供的信息,回答下列问题:
(1)“废渣1”的主要成分是 .
(2)完成“反应器2”中反应之一的离子方程式: MnO 4-+ Mn2++ = MnO2↓+ H+
(3)蘸取“反应器2”中的溶液点在 试纸上,如果观察到试纸变蓝,说明KMnO4过量.
(4)“废渣2”分离出的MnO2可用于制取MnO,已知:
2MnO2(s)+C(s)=2MnO(s)+CO2(g)△H=-174.6kJ?mol-1
C(s)+CO2(g)=2CO(g)△H=+283.0kJ?mol-1
试写出MnO2(s)与CO(g)反应制取MnO(s)的热化学方程式: .
(5)“反应器3”中加入锌粉的作用是 .
(6)“反应器4”得到的废液中,含有的主要离子除了Na+外,还有 .
(7)从“反应器4”中经过滤等操作得到碱式碳酸锌.取碱式碳酸锌3.41g,在400~450℃下加热至恒重,得到ZnO 2.43g和标准状况下CO2 0.224L,碱式碳酸锌的化学式为 .

| Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Mn(OH)2 | |
| 开始沉淀的pH | 7.5 | 2.2 | 5.2 | 6.4 | 8.6 |
| 沉淀完全的pH | 9.0 | 3.2 | 6.7 | 8.0 | 10.1 |
(1)“废渣1”的主要成分是
(2)完成“反应器2”中反应之一的离子方程式:
(3)蘸取“反应器2”中的溶液点在
(4)“废渣2”分离出的MnO2可用于制取MnO,已知:
2MnO2(s)+C(s)=2MnO(s)+CO2(g)△H=-174.6kJ?mol-1
C(s)+CO2(g)=2CO(g)△H=+283.0kJ?mol-1
试写出MnO2(s)与CO(g)反应制取MnO(s)的热化学方程式:
(5)“反应器3”中加入锌粉的作用是
(6)“反应器4”得到的废液中,含有的主要离子除了Na+外,还有
(7)从“反应器4”中经过滤等操作得到碱式碳酸锌.取碱式碳酸锌3.41g,在400~450℃下加热至恒重,得到ZnO 2.43g和标准状况下CO2 0.224L,碱式碳酸锌的化学式为