题目内容
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制取碱式碳酸镁的实验步骤如下:
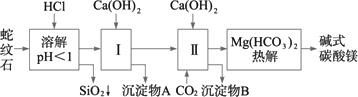
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是________.
(2)进行Ⅰ操作时,控制溶液pH=7-8(有关氢氧化物沉淀的pH见下表)
![]()
Ca(OH)2不能过量,若Ca(OH)2过量可能会导致________溶解、________沉淀.
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入________(填入物质的化学式),然后________、________、________(依次填写实验操作名称).
(4)物质循环使用,能节约资源.上述实验中,可以循环使用的物质是________(填写物质化学式).
(5)现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量 ②高温分解 ③________ ④________ ⑤MgO称量
(6)18.2 g产品完全分解后,产生6.6 g CO2和8.0 g MgO,由此可知,产品的化学式中:
a=________,b=________,c=________.
解析:
|
答案:(1)Fe3+、Al3+ (2)Al(OH)3 Mg(OH)2 (3)NaOH或Ca(OH)2 过滤 洗涤 灼烧 (4)CaCO3(或CO2) (5)用浓硫酸吸收水蒸气 称量碱石灰吸收CO2前后的质量 (6)3 1 3 (1)由蛇纹石的组成可知,与盐酸反应所得溶液中除含有Mg2+外,还应含有Fe3+、Al3+等.(2)由于Ca(OH)2为强碱,所以其过量时Al(OH)3会溶解,由表中所给氢氧化物开始沉淀的pH可知,Ca(OH)2过量时Mg(OH)2会沉淀.(3)由操作流程可知沉淀物A为Al(OH)3和Fe(OH)3的混合物,故需得到Fe2O3,需先将其中的Al(OH)3溶解并分离出去.即先加入NaOH,然后再过滤、洗涤、灼烧.(4)由于操作Ⅱ需要CO2,而Mg(HCO3)2热解时产生CO2,故可循环使用.(6)n(CO2)=0.15 mol,n(MgO)=0.2 mol,n(H2O)= |

 阅读快车系列答案
阅读快车系列答案蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下:
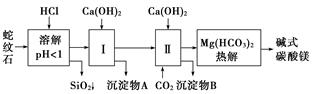
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是__________________。
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见下表)。
|
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
开始沉淀pH |
1.5 |
3.3 |
9.4 |
Ca(OH)2不能过量,若Ca(OH)2过量可能会导致________溶解、________沉淀。
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入_____________________ ___________________________________________________(填入物质的化学式),
然后______________________________________________________________________(依次填写实验操作名称)。
(4)物质循环使用,能节约资源。上述实验中,可以循环使用的物质是________(填写物质化学式)。
(5)现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量
②高温分解
③________________________________________________________________________
④________________________________________________________________________
⑤MgO称量
(6)18.2 g产品完全分解后,产生6.6 g CO2和8.0 g MgO,由此可知,产品的化学式中:
a=________,b=________,c=________。




