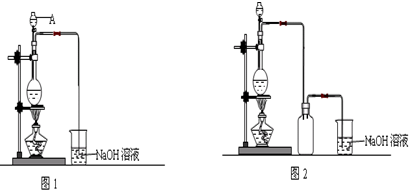
题目内容
16.用废铁屑(含Fe2O3、油污、碳及少量不溶于酸碱的杂质)制取铁红的流程如图,回答下列问题:(1)浊液B中一定含有常见的难溶物C(填化学式),热碱液的作用除去油污;
(2)溶液C加入H2O2发生反应的离子方程式H2O2+2Fe2++2H+=2Fe3++2H20;
操作II由浊液E得到80.0g Fe2O3按操作顺序应为:CED→冷却→称量;(选择合适的选项)
A.蒸发 B.烘干 C.过滤 D.灼烧 E.洗涤
(3)在C溶液加入H2O2,加热一段时间后,检验Fe2+已经反应完全的试剂是D;
A.氯水 B.KSCN溶液 C.NaOH溶液 D.KMnO4酸性溶液.
(4)已知:常温下,Ksp[Fe(OH)3]=4.0×10-38;则浊液E中Fe3+的物质的量浓度是4.0×10-8mol/L;
(5)若原铁屑质量100.0g,含铁元素质量分数70%,得到铁红80.0g,则铁屑中铁的利用率为80%.
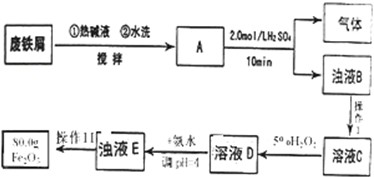
分析 用废铁屑(含Fe2O3、油污、碳及少量不溶于酸碱的杂质)加入热碱去油污水洗,加入硫酸,铁和硫酸反应生成硫酸亚铁和氢气,氧化铁和硫酸反应生成硫酸铁和水,铁和铁离子反应生成亚铁离子;碳和不溶于酸碱的物质不反应,过滤后除去不溶性物质,滤液C中含铁离子、亚铁离子;加入过氧化氢溶液把亚铁离子氧化成铁离子,加入氨水生成氢氧化铁沉淀,沉淀过滤、洗涤、灼烧、冷却后称量、再灼烧、冷却称量直到质量不变得纯净氧化铁.
(1)废铁屑中碳和不溶于酸碱物质不与硫酸反应;热碱去油污能力强;
(2)溶液C中含亚铁离子可被过氧化氢氧化成铁离子;由浊液到沉淀需过滤、洗涤,氢氧化铁到氧化铁需灼烧;
(3)亚铁离子变质生成铁离子,应检验是否存在亚铁离子;
(4)根据流程图可知溶液的pH=4,根据Ksp[Fe(OH)3]和溶液中氢氧根离子的浓度计算c(Fe3+);
(5)根据铁守恒计算,2Fe~Fe2O3.
解答 解:(1)废铁屑中碳和不溶于酸碱物质不与硫酸反应;油污在碱性条件下发生水解生成易溶于水的物质,热碱去油污能力强,通常用Na2CO3,Na2CO3溶液中存在水解离子反应为CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,热碱水解程度大,溶液呈碱性较强,
故答案为:C;除去油污;
(2)溶液C中含亚铁离子可被过氧化氢氧化成铁离子,反应的离子方程式为:H2O2+2Fe2++2H+=2Fe3++2H20;分离不溶性固体和溶液采取过滤方法;由浊液到沉淀需过滤、洗涤,氢氧化铁到氧化铁需灼烧、冷却称量、再灼烧、冷却再称量,直到两次称量差不变,记录氧化铁的质量为80.0g;
故答案为:H2O2+2Fe2++2H+=2Fe3++2H20;CED;
(3)亚铁离子变质生成铁离子,要检验是否完全变质,应检验是否存在亚铁离子;应选用高锰酸钾,看高锰酸钾是否褪色.具体步骤为:取少量C溶液,滴加几滴高锰酸钾,用力震荡,若高锰酸钾无变化,证明无亚铁离子,亚铁离子完全变质,若高锰酸钾褪色,证明亚铁离子部分未完全变质;
故答案为:D;
(4)已知溶液的pH=4,则c(H+)=10-4mol/L,c(OH-)=10-10mol/L,Ksp[Fe(OH)3]=4.0×10-38=c(Fe3+)×c3(OH-),所以c(Fe3+)=4.0×10-8mol/L;
故答案为:4.0×10-8mol/L;
(5)2Fe~Fe2O3
112 160
100.0g×70% m
m=$\frac{100.0g×70%×160}{112}$=100.0g,铁屑中铁的利用率为:$\frac{80.0g}{100.0g}$=80%,
故答案为:80%.
点评 本题考查了由废铁屑制取铁红的实验设计,中等难度,注意围绕实验目的解题,(3)为易错点,误认为得检验铁离子错选硫氰化钾溶液,或用氯水和硫氰化钾溶液,不清楚溶液中铁离子会干扰亚铁离子检验.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案 下列气体在足量的氧气中充分燃烧,产生二氧化碳和水两种物质,将产物依次通过如图中A、B装置,经完全吸收后,测得浓硫酸质量增加9g,氢氧化钠溶液增加11g,则气体可能是下列气体中的( )
下列气体在足量的氧气中充分燃烧,产生二氧化碳和水两种物质,将产物依次通过如图中A、B装置,经完全吸收后,测得浓硫酸质量增加9g,氢氧化钠溶液增加11g,则气体可能是下列气体中的( )| A. | C2H2 | B. | C2H5OH 蒸汽 | ||
| C. | CH4 | D. | CH4与H2的混合气体 |
| A. | CO→CO2 | B. | FeCl2 →FeCl3 | C. | Na2SO3 →SO2 | D. | CuO→Cu |

已知:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见上表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致Al(OH)3溶解、Mg(OH)2沉淀.
(3)物质循环使用,能节约资源上述实验中,可以循环使用的物质是CaCO3或CO2.
(4)高温煅烧碱式碳酸镁aMgCO3•bMg(OH)2•cH2O得到MgO.取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下CO2 0.896L,通过计算确定碱式碳酸镁的化学式为4MgCO3•Mg(OH)2•4H2O.(写出计算过程,否则不得分)
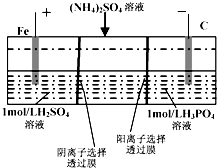 用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示.下列说法正确的是( )
用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示.下列说法正确的是( )| A. | 阳极室溶液由无色变成棕黄色 | |
| B. | 电解一段时间后,阴极室溶液中的pH升高 | |
| C. | 阴极的电极反应式为:4OH--4e-═2H2O+O2↑ | |
| D. | 电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4 |