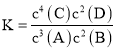题目内容
【题目】甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
Ⅰ.用CO2生产甲醇
(1)已知:H2的燃烧热为-285.8 kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,CH3OH(g)= CH3OH(l)△H=-37.3 kJ/mol,则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l)△H=_______kJ/mol。
CH3OH(g)+H2O(l)△H=_______kJ/mol。
(2)将CO2和H2按物质的量之比1:3充入体积为2.0 L的恒容密闭容器中反应,如图两条曲线分别表示压强为0.1 M Pa和5.0 MPa下CO2转化率随温度的变化关系。
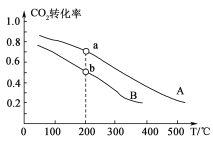
①其中a点的平衡常数表达式为:_________________。
②a,b两点化学反应速率分别用va、vb表示,则va________vb (填“大于”、“小于”或“等于”)。
(3)在1.0 L恒容密闭容器中投入1 mol CO2和2.75 mol H2发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示,下列说法正确的是___________。
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示,下列说法正确的是___________。
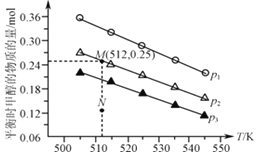
A. 该反应的正反应为放热反应
B. 压强大小关系为p1<p2<p3
C. M点对应的平衡常数K的值约为1.04×10-2
D. 在p2及512K时,图中N点v(正)<v(逆)
Ⅱ.用![]() 生产甲醇
生产甲醇
(4)已知:CO(g)+2H2(g)![]() CH3OH(g),如图是该反应在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),如图是该反应在不同温度下CO的转化率随时间变化的曲线。
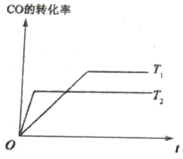
①该反应的焓变△H ______0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_________K2(填“>”“<”或“=”)。
Ⅲ.甲醇的应用
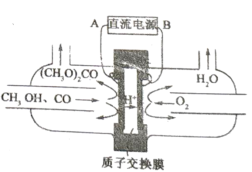
(5)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图所示。阳极的电极反应式为___________。
【答案】-94.3 ![]() 大于 AC < > 2CH3OH+CO-2e-=(CH3O)2CO+2H+
大于 AC < > 2CH3OH+CO-2e-=(CH3O)2CO+2H+
【解析】
I.(1)将已知的热化学方程式叠加,可得待求反应的热化学方程式,据此求算△H;
(2)①平衡常数K=![]() 书写;
书写;
②温度相同时,依据压强与二氧化碳的转化率关系判断A、B所在曲线的压强高低,结合温度对速率的影响判断va与vb;
(3)A. 根据图象,随着温度升高,平衡时甲醇的物质的量在减小,所以升温平衡向逆反应方向移动;
B. 根据图象,作一条等温线,根据该反应为气体体积减小的反应,压强越大,平衡时甲醇的物质的量也越大判断;
C. 由图可知,M点对应的甲醇产量为0.25 mol,根据物质反应转化关系,计算各种物质的平衡物质的量及浓度,然后结合平衡常数K含义计算;
D. 由图可知,在p2及512 K时,N点甲醇的物质的量还小于平衡时的量,所以应该正向移动;
(4)①由图象可知升高温度CO的转化率降低,说明升高温度,化学平衡逆向移动;
②根据平衡常数的含义及温度对平衡移动的影响分析比较K的关系;
(5)阳极上甲醇失电子和CO反应生成碳酸二甲酯。
I.(1)由CO、H2、CH3OH(g)的燃烧热可得热化学方程式:
①H2(g)+![]() O2(g)=H2O(l) △H1=-285.8 kJ/mol;②CH3OH(g)+
O2(g)=H2O(l) △H1=-285.8 kJ/mol;②CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) △H2=-725.8 kJ/mol;③CH3OH(g)=CH3OH(l) △H3= -37.3 kJ/mol,根据盖斯定律可知,3×①-②-③,整理可得CO2(g)+3H2(g)
O2(g)=CO2(g)+2H2O(l) △H2=-725.8 kJ/mol;③CH3OH(g)=CH3OH(l) △H3= -37.3 kJ/mol,根据盖斯定律可知,3×①-②-③,整理可得CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l)△H=-94.3 kJ/mol;
CH3OH(g)+H2O(l)△H=-94.3 kJ/mol;
(2)①对于反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),根据平衡常数含义可知a点时反应平衡常数表达式为:K=
CH3OH(g)+H2O(g),根据平衡常数含义可知a点时反应平衡常数表达式为:K=![]() ;
;
②该反应的正反应是气体体积减小的反应,在温度相同时,增大压强,平衡向正反应方向移动,则CO2的转化率增大,由图可知a点CO2的转化率比b点大,增大压强,反应速率加快,所以反应速率:va>vb;
(3)A. 由图可知,随着温度升高,平衡时甲醇的物质的量在减小,说明升温平衡向逆反应方向移动,逆反应为吸热反应,故该反应的正反应为放热反应,A正确;
B. 由图可知,作一条等温线,由于该反应的正反应是气体体积减小的反应,压强越大,平衡时甲醇的物质的量也越大,所以p1>p2>p3,B错误;
C. 由图可知,M点对应的甲醇产量为0.25 mol,则根据反应方程式CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)中物质反应关系可知:反应产生甲醇0.25 mol,则会同时产生0.25 mol H2O,会同时消耗0.25 mol CO2,消耗3×0.25 mol=0.75 mol H2,所以平衡时各种气体的物质的量分别为n(CO2)=0.75 mol,n(H2)=2 mol,n(CH3OH)=n(H2O)=0.25 mol,由于容器的体积为1.0 L,所以K=
CH3OH(g)+H2O(g)中物质反应关系可知:反应产生甲醇0.25 mol,则会同时产生0.25 mol H2O,会同时消耗0.25 mol CO2,消耗3×0.25 mol=0.75 mol H2,所以平衡时各种气体的物质的量分别为n(CO2)=0.75 mol,n(H2)=2 mol,n(CH3OH)=n(H2O)=0.25 mol,由于容器的体积为1.0 L,所以K=![]() =1.04×10-2,C正确;
=1.04×10-2,C正确;
D. 由图可知,在p2及512 K时,N点甲醇的物质的量还小于平衡时的量,说明反应应该正向移动,则v(正)>v(逆),D错误;
故合理选项是AC;
(4)①由图象可知:升高温度CO的转化率降低,说明升高温度,化学平衡逆向移动,逆反应是吸热反应,则该反应的正反应是放热反应,所以△H<0;
②温度升高,反应速率加快,达到平衡所需要的时间缩短,所以根据图象可知在温度为T2时先达到平衡,所以温度T2>T1,由图象可知:升高温度CO的转化率降低,说明升高温度化学平衡向逆反应方向移动,则K减小,因此即K1>K2;
(5)阳极上甲醇失电子和CO反应生成碳酸二甲酯,电极反应式为:2CH3OH+CO-2e-═(CH3O)2CO+2H+。

【题目】下列实验操作、现象及结论均正确的是 ( )
选项 | 实验操作 | 实验现象 | 实验结论 |
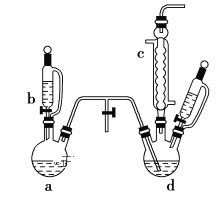
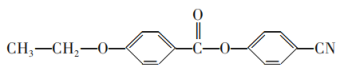
A | 将盛有等物质的量的氯气和甲烷的硬质大试管放在光亮处 | 试管内气体颜色变浅,试管壁出现油状液滴,试管中有少量白雾 | 甲烷和氯气发生了加成反应 |
B | 向葡萄糖溶液中滴加新制的氢氧化铜溶液,小火加热 | 有砖红色沉淀生成 | 葡萄糖中含有醛基 |
C | 向 | 产生有香味的液体,沉在饱和碳酸钠溶液底部 | 有乙酸乙酯生成 |
D | 将苯与液溴的混合物装入洁净试管中,振荡一段时间后,将混合物倒入盛有水的烧杯中 | 烧杯底部有油状液体 | 苯与液溴发生了取代反应,溴苯难溶于水,密度比水大 |
A.AB.BC.CD.D