题目内容
17.如图所示,两电极上发生的电极反应为
则下列说法中不正确的是( )
| A. | 该装置为原电池 | |
| B. | a极上发生还原反应 | |
| C. | 电子由b→a | |
| D. | 该过程中能量的转换只有化学能与电能的转化 |
分析 A、该电池将化学能转化为电能;
B、a极是铜离子得电子,生成铜单质,发生还原反应;
C、电子由负极流向正极;
D、化学能还转化为光能和热能.
解答 解:A、该电池将化学能转化为电能,所以该电池是原电池,故A正确;
B、a极是铜离子得电子,生成铜单质,发生还原反应,故B正确;
C、电子由负极流向正极,即电子由b→a,故C正确;
D、化学能还转化为光能和热能,不仅是化学能与电能的转化,故D错误;
故选D.
点评 本题考查原电池的知识,侧重于学生的分析能力和电化学知识的综合考查,为高考常见题型和高频考点,注意原电池的工作原理,难度不大.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
5.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd+2NiO(OH)+2H2O $?_{充电}^{放电}$ Cd(OH)2+2Ni(OH)2,下列叙述中正确的是( )
| A. | 该电池放电的时候,负极材料是Ni(OH)2 | |
| B. | 放电时每转移3mol的电子时,正极有3mol的NiO(OH)被氧化 | |
| C. | 充电时,阴极附近PH增大 | |
| D. | 充电时,阳极反应是Cd(OH)2+2e-=Cd+2 OH- |
12.某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液中,探究Fe2+和I-的还原性强弱.
假设1:Fe2+还原性比I-强.假设2:I-还原性比Fe2+强.
选择几种装置进行实验:
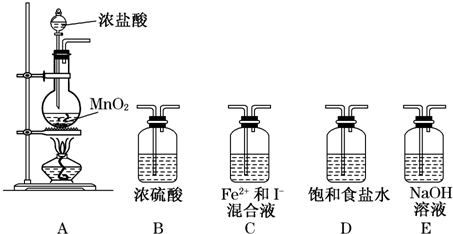
(1)实验必需的装置是A→C→E(按Cl2气流方向的顺序填写).
(2)请在下表中写出实验步骤及预期现象和结论.
(3)为了实验成功,必须控制各物质的量.该小组称取1.52g FeSO4固体,同时称取1.66g KI固体,溶于水中配成混合溶液.为了验证上述假设,通入的Cl2体积最多不能超过0.112L(标准状况).
(4)有同学质疑,上述实验中Cl2量很难控制,无法验证Fe2+和I-反应的先后顺序.于是提出另一方案:往KI溶液中滴入FeCl3溶液,如果能发生反应,即可证明I-的还原性强于Fe2+.
假设1:Fe2+还原性比I-强.假设2:I-还原性比Fe2+强.
选择几种装置进行实验:

(1)实验必需的装置是A→C→E(按Cl2气流方向的顺序填写).
(2)请在下表中写出实验步骤及预期现象和结论.
| 实验步骤 | 预期现象和结论 |
| 取少量反应后的混合溶液分别置于A、B两试管中:往A中滴加KSCN溶液;往B中滴加淀粉溶液 | ①A中溶液变红,B中溶液不变蓝, 则假设1成立. ②A中溶液不变红,B中溶液变蓝, 则假设2成立. |
(4)有同学质疑,上述实验中Cl2量很难控制,无法验证Fe2+和I-反应的先后顺序.于是提出另一方案:往KI溶液中滴入FeCl3溶液,如果能发生反应,即可证明I-的还原性强于Fe2+.
9.对于某些离子的检验及结论一定正确的是( )
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入稀盐酸无明显现象,再加入氯化钡溶液有白色沉淀产生,一定有SO42- | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加入盐酸白色沉淀消失,一定有Ba2+ |
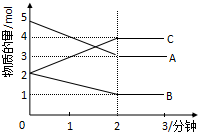 某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.则该反应的反应物是A、B,生成物是C,化学方程式为2A+B?2C;反应开始至2分钟时,能否用C表示反应速率?若能,其反应速率为空,若不能,则其原因为无体积,无法求出浓度变化值;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了化学平衡状态.
某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.则该反应的反应物是A、B,生成物是C,化学方程式为2A+B?2C;反应开始至2分钟时,能否用C表示反应速率?若能,其反应速率为空,若不能,则其原因为无体积,无法求出浓度变化值;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了化学平衡状态.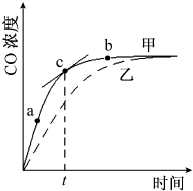 ①在温度、容积恒定的反应体系中,CO浓度随时间的变化关系如图曲线甲所示.下列说法不正确的是CD.
①在温度、容积恒定的反应体系中,CO浓度随时间的变化关系如图曲线甲所示.下列说法不正确的是CD.
 .
.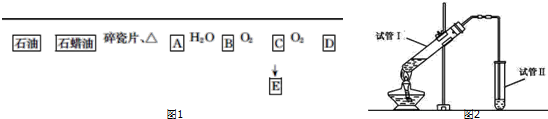
 .
.