题目内容
已知甲元素是第三周期p区元素,其最低氧化值为-1,乙元素是第四周期d区元素,其最高氧化值为+4,试填下表:元素 | 价电子构型 | 族 | 金属或非金属 | 电负性相对高低 |
甲 |
|
|
|
|
乙 |
|
|
|
|
解析:甲:第三周期p区元素,最低氧化值-1,则最高氧化值+7,为Cl;乙:第四周期d区元素,最高氧化值+4,则电子构型4s23d2。元素为Ti。
答案:
元素 | 价电子构型 | 族 | 金属或非金属 | 电负性相对高低 |
甲 | 3s23p5 | ⅦA | 非金属 | 较高 |
乙 | 4s23d2 | ⅣB | 金属 | 较低 |

练习册系列答案
相关题目
已知甲元素是第三周期p区元素,其最低氧化值为-1,乙元素是第四周期d区元素,其最高氧化值为+4,试填下表:
| 元素 | 价电子构型 | 族 | 金属或非金属 | 电负性相对高低 |
| 甲 | ||||
| 乙 |
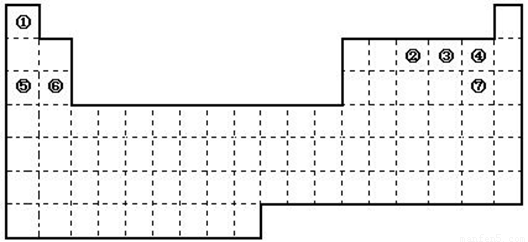
(20分)下图是元素周期表的框架
(1)请在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)依据元素周期表回答下列问题:
| A.周期表中的元素⑤和元素⑥的最高价氧化物的水化物碱性强弱顺序是(用化学式表示)。 |
| B.周期表中的元素④和元素⑦的氢化物的熔、沸点高低顺序是(用化学式表示)。 |
| C.①~⑦元素的单质,在常温下化学性质稳定,通常可用作保护气的是(填写结构式)。 |
| D.在上面元素周期表中全部是金属元素的主族是;全部是非金属元素的主族是(填写字母a、b、c、d)。 |
(3)已知甲元素位于第三周期,且其原子半径为同周期金属元素中原子半径最小的,请写出甲的氧化物与NaOH溶液反应的离子方程式 ;
(4)请写出仅用①②④三种元素形成离子化合物的电子式_________。若用球棍模型表示①和③形成的化合物的分子结构,应该是 。

⑸ 在120℃下1g①的单质在足量③的单质中完全燃烧,放出的热量为a kJ;请写出此条件下①的单质燃烧的热化学方程式 ;
①、③两种元素的单质已被应用于字宙飞船的燃料电池中,如图所示,两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出并在电极表面放电。
请回答:b是电池的 极;a电极上的电极反应式是 。