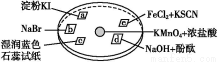
题目内容
如图表示常见元素单质及化合物相应关系,某些生成物已略去。

已知:反应①为氯碱工业的基础反应;X、Y为常见金属,Z为形成酸雨的主要成分。请回答下列问题:
(1)D的电子式 ;H为 (填化学式)。
(2)完成下列方程式:
①空气中含量最高的气体与C反应的化学反应方程式 ;
②反应②的化学反应方程式 ;
③足量B通入H溶液的离子反应方程式 。
(1)Na+ H]- NaHSO3
H]- NaHSO3
(2)①N2+3H2 2NH3
2NH3
②2Al+Fe2O3 2Fe+Al2O3(或2Al+3CuO
2Fe+Al2O3(或2Al+3CuO 3Cu+Al2O3)
3Cu+Al2O3)
③Cl2+HSO3-+H2O=2Cl-+SO42-+3H+
【解析】氯碱工业基础反应为电解饱和食盐水的反应,反应方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑,故D为NaOH;又因为B能与金属X反应,故B、C分别为Cl2、H2;联想Cl2能与Fe、Cu、Na等反应,若X为Fe(Cu),则E为FeCl3(CuCl2),F为Fe2O3(CuO);反应②为金属与金属氧化物在高温下发生的反应,应该是铝热反应,可推测Y为Al,则G为Al2O3,则I为NaAlO2。形成酸雨的主要气体为SO2和NOx,过量二氧化硫气体通入氢氧化钠溶液生成NaHSO3,NaAlO2溶液中通过量SO2气体也生成NaHSO3。若Z为NO2,NO2通入NaOH溶液生成NaNO3、NaNO2和H2O,题中H溶液中溶质只有一种,所以Z只能为SO2,H为NaHSO3。空气中含量最高的气体为N2,N2与H2反应方程式为N2+3H2
2NaOH+H2↑+Cl2↑,故D为NaOH;又因为B能与金属X反应,故B、C分别为Cl2、H2;联想Cl2能与Fe、Cu、Na等反应,若X为Fe(Cu),则E为FeCl3(CuCl2),F为Fe2O3(CuO);反应②为金属与金属氧化物在高温下发生的反应,应该是铝热反应,可推测Y为Al,则G为Al2O3,则I为NaAlO2。形成酸雨的主要气体为SO2和NOx,过量二氧化硫气体通入氢氧化钠溶液生成NaHSO3,NaAlO2溶液中通过量SO2气体也生成NaHSO3。若Z为NO2,NO2通入NaOH溶液生成NaNO3、NaNO2和H2O,题中H溶液中溶质只有一种,所以Z只能为SO2,H为NaHSO3。空气中含量最高的气体为N2,N2与H2反应方程式为N2+3H2 2NH3。反应②化学方程式为:2Al+Fe2O3
2NH3。反应②化学方程式为:2Al+Fe2O3 2Fe+Al2O3或2Al+3CuO
2Fe+Al2O3或2Al+3CuO 3Cu+Al2O3。Cl2具有氧化性,HS
3Cu+Al2O3。Cl2具有氧化性,HS 具有还原性,足量Cl2通入NaHSO3溶液中发生氧化还原反应,离子方程式为Cl2+HSO3-+H2O=2Cl-+SO42- +3H+。
具有还原性,足量Cl2通入NaHSO3溶液中发生氧化还原反应,离子方程式为Cl2+HSO3-+H2O=2Cl-+SO42- +3H+。

以粗氧化锌粉(含FeO、Fe2O3、ZnS等)制取活性ZnO的工艺如下:
步骤1:以H2SO4浸出粗氧化锌,同时加入H2O2;
步骤2:过滤,调节滤液的pH;
步骤3:过滤,向滤液中加NH4HCO3,得碱式碳酸锌沉淀;
步骤4:过滤、洗涤、煅烧,得产品。
已知:离子沉淀的pH见下表。
离子 | 开始沉淀pH | 沉淀完全pH |
Fe2+ | 7.6 | 9.6 |
Fe3+ | 2.7 | 3.7 |
Zn2+ | 5.4 | 8.0 |
(1)加入H2O2时能浸出硫化锌,同时生成淡黄色固体,写出其化学方程式 。
(2)步骤2中调节溶液pH的范围是 。
(3)取洗涤、干燥后的碱式碳酸锌68.2 g,充分灼烧后测得残留物质的质量为48.6 g,将所得气体通入足量澄清石灰水中,得沉淀20 g。计算碱式碳酸锌的组成(用化学式表示,写出计算过程)。