题目内容
【题目】研究化学反应与能量的变化具有重要意义。
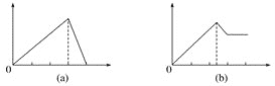
![]() 已知
已知![]() 的反应过程的能量变化如图1:
的反应过程的能量变化如图1:

![]() 该反应通常用
该反应通常用![]() 作为催化剂,加入
作为催化剂,加入![]() 会使图中的B点________
会使图中的B点________![]() 填“升高”、“不变”或“降低”
填“升高”、“不变”或“降低”![]() 。
。
![]() E
E![]() 表示的意义为___________。
表示的意义为___________。
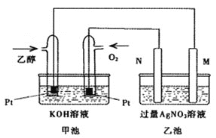
![]() 如图2中的a和b为氢镍可充电碱性电池的电极,该电池总反应式为:
如图2中的a和b为氢镍可充电碱性电池的电极,该电池总反应式为:![]()
![]() 为了实现铜与稀硫酸反应,用Z通入氧气的同时,将开关K与Y相连即可。石墨电极的反应式为___________,总反应的化学方程式为__________。
为了实现铜与稀硫酸反应,用Z通入氧气的同时,将开关K与Y相连即可。石墨电极的反应式为___________,总反应的化学方程式为__________。
![]() 不通入氧气,直接将K与X相连也能实现铜与稀硫酸反应。则氢镍碱性电池的负极为____
不通入氧气,直接将K与X相连也能实现铜与稀硫酸反应。则氢镍碱性电池的负极为____![]() 填“a”或“b”
填“a”或“b”![]() ,电解槽内总反应的离子方程式为______________________。
,电解槽内总反应的离子方程式为______________________。
![]() 当给氢镍碱性电池充电时,该电池的正极反应式为______;氢镍电池放电时,负极附近的pH会________
当给氢镍碱性电池充电时,该电池的正极反应式为______;氢镍电池放电时,负极附近的pH会________![]() 填“变大”、“不变”或“变小”
填“变大”、“不变”或“变小”![]() 。
。
![]() 若将
若将![]() 题图2中的稀硫酸换成
题图2中的稀硫酸换成![]() 溶液,并且将氢镍碱性电池的电极反接,将K连接X,通电一段时间后,向所得溶液中加入
溶液,并且将氢镍碱性电池的电极反接,将K连接X,通电一段时间后,向所得溶液中加入![]() 碱式碳酸铜
碱式碳酸铜![]() 后,恰好恢复到原来的浓度和
后,恰好恢复到原来的浓度和![]() 不考虑
不考虑![]() 的溶解
的溶解![]() ,则电解过程中转移电子的物质的量为__________。
,则电解过程中转移电子的物质的量为__________。
【答案】降低 ![]() 完全分解反应的活化能或2molS和6molO生成
完全分解反应的活化能或2molS和6molO生成![]() 释放的能量
释放的能量 ![]()
![]()
![]()
![]()
![]()
![]()
![]() 变小
变小 ![]()
【解析】
根据图示中反应过程中能量变化及催化剂对反应速率影响原理分析解答;根据电解池原理及放电顺序书写电极反应和总反应方程式;根据放电顺序及电子转移守恒计算电解过程中转移的电子数。
![]() 表示反应物化学键断裂吸收的能量、
表示反应物化学键断裂吸收的能量、![]() 表示生成物形成时释放的能量,加入催化剂,可降低反应的活化能;
表示生成物形成时释放的能量,加入催化剂,可降低反应的活化能;![]() 表示的意义为
表示的意义为![]() 完全分解反应的活化能或2molS和6molO生成
完全分解反应的活化能或2molS和6molO生成![]() 释放的能量;故答案为:降低;
释放的能量;故答案为:降低;![]() 完全分解反应的活化能或2molS和6molO生成
完全分解反应的活化能或2molS和6molO生成![]() 释放的能量;
释放的能量;
![]() 为了实现铜与稀硫酸反应,用Z通入氧气的同时,将开关K与Y相连,形成原电池反应,铜为负极被氧化,通入氧气的一极为正极,总反应生成硫酸铜;故答案为:
为了实现铜与稀硫酸反应,用Z通入氧气的同时,将开关K与Y相连,形成原电池反应,铜为负极被氧化,通入氧气的一极为正极,总反应生成硫酸铜;故答案为:![]() ;
;![]() ;
;
①不通入氧气,直接将K与X相连也能实现铜与稀硫酸反应,铜应为阳极,则原电池a为负极,b为正极,铜被氧化,阴极生成氢气;故答案为:a;![]()
![]()
![]() ;
;
②当给氢镍碱性电池充电时,该电池的阳极发生氧化反应,![]() 被氧化生成
被氧化生成![]() ,氢镍电池放电时,负极上氢气被氧化生成水;故答案为:
,氢镍电池放电时,负极上氢气被氧化生成水;故答案为:![]() ;变小;
;变小;
![]() 若将图2中的稀硫酸换成
若将图2中的稀硫酸换成![]() 溶液,并且将氢镍碱性电池的电极反接,将K连接X,铜为阴极,Y为阳极,阴极上铜离子和氢离子放电、阳极上氢氧根离子放电,碱式碳酸铜和稀硫酸反应生成硫酸铜、水和二氧化碳,所以加入
溶液,并且将氢镍碱性电池的电极反接,将K连接X,铜为阴极,Y为阳极,阴极上铜离子和氢离子放电、阳极上氢氧根离子放电,碱式碳酸铜和稀硫酸反应生成硫酸铜、水和二氧化碳,所以加入![]() 碱式碳酸铜
碱式碳酸铜![]() 相当于加入
相当于加入![]() 、
、![]() ,根据生成物知,阴极上铜离子和氢离子放电、阳极上氢氧根离子放电,根据Cu原子、H原子守恒得阴极上析出
,根据生成物知,阴极上铜离子和氢离子放电、阳极上氢氧根离子放电,根据Cu原子、H原子守恒得阴极上析出![]() 、
、![]() ,则转移电子的物质的量
,则转移电子的物质的量![]() ;故答案为:
;故答案为:![]() 。
。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案【题目】在一定温度下,将气体 X 和气体 Y 各 0.16mol 充入 ![]() 恒容密闭容器中,发生反应:
恒容密闭容器中,发生反应:![]()
![]() ,一段时间后达到平衡。反应过程中测定的数据如下表:
,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前 ![]() 的平均速率
的平均速率 ![]()
B.该温度下此反应的平衡常数 ![]()
C.其他条件不变,再充入 ![]() Z ,平衡时 X 的体积分数不变
Z ,平衡时 X 的体积分数不变
D.其他条件不变,降低温度,反应达到新平衡前 v(逆)> v(正)
【题目】如表所示有关物质检验的实验结论正确的是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀产生 | 该溶液中一定含有SO42- |
B | 向某溶液中加入盐酸,将生成的气体通入品红溶液中,品红溶液褪色 | 该溶液一定含有 SO32- |
C | 将某气体通入品红溶液中,品红溶液褪色 | 说明酸性:H2SO3>H2CO3 |
D | 某气体先通入足量的酸性 KMnO4 溶液,再通入澄清石灰水中有浑浊 | 该气体一定是 CO2 |
A.AB.BC.CD.D