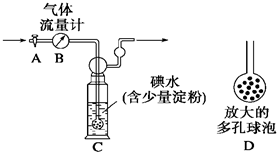
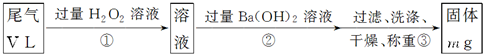题目内容
0.2 L 0.05 mol·L-1的AlCl3溶液与0.1 L 0.3 mol·L-1的NaCl溶液中,Cl-的物质的量浓度之比为( )A.1∶1 B.1∶2 C.2∶1 D.3∶1
答案:B
提示:
提示:
| 0.05
mol·L-1的AlCl3溶液中c(Cl-)=0.05 mol·L-1×3=0.15
mol·L-1
0.3 mol·L-1的NaCl溶液中c(Cl-)=0.3 mol·L-1×1=0.3 mol·L-1 所以Cl-的物质的量浓度之比为0.15 mol·L-1∶0.3 mol·L-1=1∶2,答案为B。
|

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目