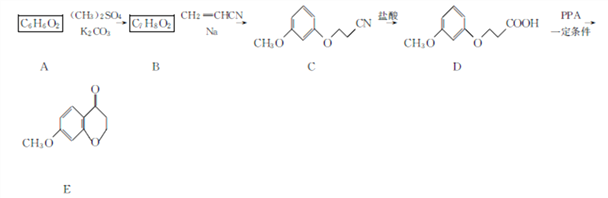
题目内容
【题目】下列有关化学键的叙述,正确的是( )
A.硫酸氢钠溶于水既有离子键被破坏又有共价键被破坏
B.单质分子中均含共价键
C.HF与HBr相比,分子内共价键更强,所以HF沸点更高
D.由不同元素组成的多原子分子里,只存在极性键
【答案】A
【解析】解:A.硫酸氢钠溶于水的电离方程式为NaHSO4=Na++H++SO42﹣ , 所以硫酸氢钠溶于水的过程中既有离子键被破坏又有共价键被破坏,故A正确;
B.单原子分子不存在共价键,如He等,故B错误;
C.HF分子间含有氢键,沸点较高,与共价键无关,故C错误;
D.不同元素组成的多原子分子里可能存在非极性键,如H2O2等,故D错误.
故选A.

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g100ml﹣1).
(1)Ⅰ.实验步骤:
用(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到转移到 (填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴作指示剂.
(3)读取盛装0.1000mol/L NaOH溶液的碱式滴定管的初始读数.
滴定.当时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
(4)Ⅱ.实验记录:
滴定次数 | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
甲同学在处理数据时计算得:平均消耗的NaOH溶液的体积V= ![]() mL=15.24mL.指出他的计算的不合理之处: .
mL=15.24mL.指出他的计算的不合理之处: .
(5)乙同学仔细研究了该品牌白醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与苯甲酸钠不会发生离子交换反应,需查找在一定温度下醋酸和苯甲酸的(填写序号)
a.电离常数 b.溶解度
(6)在本实验的滴定过程中,下列操作会使实验结果偏大的是(填写序号) .
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.