题目内容
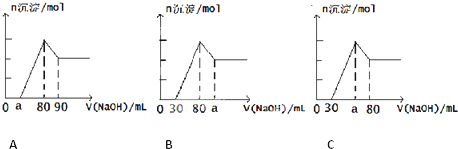
把一块镁铝合金投入到1mol?L-1 盐酸中,待合金完全溶解后,再往溶液里加入1mol?L-1 NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是( )

| A.盐酸的体积为80mL |
| B.a的取值范围为0<a<50 |
| C.n(Mg2+)<0.025mol |
| D.当a值为30时,b值为0.01 |

A、第一阶段,盐酸和氢氧化钠反应:H++OH-=H2O;第二阶段,氯化镁和氯化铝和氢氧化钠反应Mg2++2OH-=Mg(OH)2↓,Al3++3OH-=Al(OH)3↓,在V(NaOH)=80mL时,溶液中溶质全为NaCl,所以盐酸的体积为80mL,故A正确;
B、第三阶段,氢氧化铝溶解Al(OH)3 +NaOH=NaAlO2+2H2O,因为此时消耗NaOH10mL,所以n(Al3+)=0.01mol,和Al3+反应的NaOH为30mL,因为第一阶段和Al3+反应的NaOH为30mL,假设无Mg2+,a=50,而实际存在Mg2+,所以0<a<50,故B正确;
C、第三阶段,氢氧化铝溶解Al(OH)3 +NaOH=NaAlO2+2H2O,因为此时消耗NaOH10mL,所以n(Al3+)=0.01mol,第四阶段无反应,沉淀全为Mg(OH)2,若a=0,n(Mg2+)取得最大值,
第一阶段,和Al3+反应的NaOH为30mL,所以此时和Mg2+反应的NaOH为50ml,(Mg2+)max=0.025mol,而如图所示a>0,所以n(Mg2+)<0.025mol,故C正确;
D、a=30时,和Mg2+反应的NaOH为20ml,此时n(Mg2+)=0.01mol,b=n(Mg2+)+n(Al3+)=0.02mol,故D错误.
故选D.
B、第三阶段,氢氧化铝溶解Al(OH)3 +NaOH=NaAlO2+2H2O,因为此时消耗NaOH10mL,所以n(Al3+)=0.01mol,和Al3+反应的NaOH为30mL,因为第一阶段和Al3+反应的NaOH为30mL,假设无Mg2+,a=50,而实际存在Mg2+,所以0<a<50,故B正确;
C、第三阶段,氢氧化铝溶解Al(OH)3 +NaOH=NaAlO2+2H2O,因为此时消耗NaOH10mL,所以n(Al3+)=0.01mol,第四阶段无反应,沉淀全为Mg(OH)2,若a=0,n(Mg2+)取得最大值,
第一阶段,和Al3+反应的NaOH为30mL,所以此时和Mg2+反应的NaOH为50ml,(Mg2+)max=0.025mol,而如图所示a>0,所以n(Mg2+)<0.025mol,故C正确;
D、a=30时,和Mg2+反应的NaOH为20ml,此时n(Mg2+)=0.01mol,b=n(Mg2+)+n(Al3+)=0.02mol,故D错误.
故选D.

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
把一块镁铝合金投入到1mol/L HCl溶液里,待合金完全溶解后,往溶液里加入1mol/LNaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如下图A所示.下列说法中不正确的是( )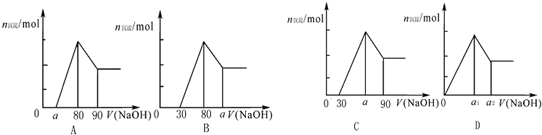

| A、a的取值范围为0≤a<50 | ||
B、
| ||
| C、若将关系图改为B图时,则a的取值范围为80<a<90 | ||
| D、若将关系图改为C图时,则a的取值范围为75<a<90 |
把一块镁铝合金投入到1mol/L HCl溶液里,待合金完全溶解后,往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图A所示.下列说法不正确的是( )

| A、A图中a的取值范围为0≤a<50 | ||
B、A图中
| ||
| C、若将关系图改为B图时,则a的取值范围为80<a<90 | ||
| D、若将关系图改为C图时,则a的取值范围为67.5<a<80 |

 (2011?抚顺二模)把一块镁铝合金投入到1mol?L-1 盐酸中,待合金完全溶解后,再往溶液里加入1mol?L-1 NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是( )
(2011?抚顺二模)把一块镁铝合金投入到1mol?L-1 盐酸中,待合金完全溶解后,再往溶液里加入1mol?L-1 NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是( ) 把一块镁铝合金投入到1mol/L HCl溶液里,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是( )
把一块镁铝合金投入到1mol/L HCl溶液里,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是( )