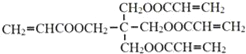��Ŀ����
����Ŀ����һ���¶��£�������X������Y��0.16 mol����10 L�����ܱ������У�������Ӧ��X (g) +Y (g)![]() 2Z (g) ��H<0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������±���
2Z (g) ��H<0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������±���
����˵����ȷ����
![]()
A. ��Ӧǰ2 min��ƽ������v(Z) =2.0��l0��3mol.L��l��min��l
B. �����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰ��v���棩>v������
C. ���������������䣬��ʼʱ�������г���0.32 mol����X��0.32 moI����Y������ƽ��ʱ��C (Z) =0.24 mol��L��l
D. ���¶��´˷�Ӧ��ƽ�ⳣ����K=l. 44
���𰸡�D
��������A��V(Y)=(0.16��0.12)/2��10=0.002mol��L��1min-1����V(Z)= 0.004mol��L��1min-1��A�������B�����£�ƽ�������ƶ��������ƽ��ǰ��v������>v���棩��B�����
C��X��g��+Y��g���T2Z��g����ͼ�����ݷ���ƽ�������YΪ0.16mol-0.1mol=0.06mol������ZΪ0.12mol�����������������䣬��ʼʱ�������г���0.32mol����X��0.32mol����Y���൱�ڵ�ЧΪ��ԭƽ�����������ѹǿ����Ӧǰ�������������䣬ƽ�ⲻ�ƶ�������ƽ��ʱ��n��Z��=0.24mol��C (Z) =0.24 mol��10L=0.024 mol��L��l��C����
D�� X(g) �� Y(g)![]() 2Z(g) ��H < 0
2Z(g) ��H < 0
��ʼ 0.16 0.16 0
�仯 0.06 0.06 0.12
ƽ�� 0.10 0.10 0.12
K=0.0122/0.01��0.01=1.44��D����ȷ��

����Ŀ����1������Ϊ��������Ҫ������ϩ�����ƻ������顢�״������Ƽ�ȩ�ȡ�Ŀǰ���������г�������������ӵ����ơ���д���״����������Ʊ���ȩ�Ļ�ѧ����ʽ
________________________________________________________________��
��2����������ʹ�ù����У�������������ѡ���Խ��ͣ�һ��ʱ�����������ij������ʧЧ���������л��ղ�ʵ�������������������£�

��֪����������Ҫ�ɷ֣�X����ӫ�����������
Ԫ�� | Al2O3 | Ag | MgO | SiO2 | K2O | Fe2O3 |
����% | 82 | 14.8 | 1.4 | 0.9 | 0.5 | 0.1 |
���ϣ���X���������Ǽ�⣬�����������ľ���Ϊ���ͣ������ᡣ
�ٲ���a�Ͳ���b��������_________��
����д�����̢�������ϡ���ᷴӦ�����ӷ���ʽ
________________________________________________________________��
��3����Һ2 �к��ж��ֽ������ӣ��������������K+��ʵ�鷽��
____________________________________________________________________��
��4����ϻ�ѧ�����ƽ���ƶ��ǶȽ����̢����ð�ˮ���Ȼ��������ܽ��ԭ
��_______________________________________________________________��
��5�����̢������£�N2H4����Ϊ��ԭ�������в�����������ʡ���ԭ��ǿ���õ������ȸߵ��ŵ㣬�ù��̵Ļ�ѧ����ʽΪ��
________________________________________________________��
��6�����ù��̢�ʵ�������������������װ��ͼ���£�

д�����������ĵ缫��Ӧʽ��________________________________��