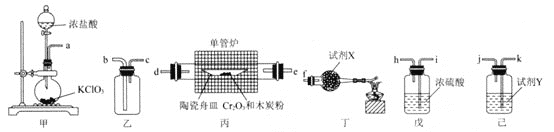
题目内容
【题目】氧化锌为白色粉末,可用于皮肤病的治疗。提纯工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
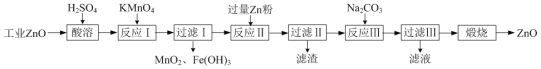
已知:相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 8.2 | 8.9 |
(1)写出两种“酸溶”时可以加快反应速率的方法__________、__________。
(2)“反应Ⅰ”溶液的pH≈5,“反应Ⅰ”目的是除去Fe(Ⅱ)、Mn(Ⅱ),写出“反应Ⅰ”中除去Mn(Ⅱ)的离子方程式:__________。
(3)“过滤Ⅱ”所得滤渣的成分为__________。
(4)向“过滤Ⅱ”所得滤液中滴加Na2CO3溶液,所得沉淀为ZnCO3,若反过来滴加,则沉淀中会含有Zn(OH)2。反过来滴加生成Zn(OH)2的原因是__________。
⑸“过滤Ⅲ”所得沉淀需进行洗涤,检查沉淀已经洗涤干净的方法是__________。
【答案】升高温度 适当增加硫酸的浓度(或充分搅拌等) 2MnO4-+3Mn2++2H2O=5MnO2↓+4H+ Zn、Ni 因为Na2CO3水解而使溶液呈碱性,Zn2+在碱性条件下会生成Zn(OH)2沉淀 取最新得到的洗涤滤液少许,先滴加盐酸酸化,再滴加BaCl2溶液,无沉淀生成
【解析】
(1)升高温度、适当增加硫酸溶液的浓度、搅拌等都可使反应速率加快;
(2)将“反应Ⅰ”溶液的pH控制在5左右,高锰酸钾可将Mn2+氧化为MnO2沉淀;
(3)加入过量的Zn粉后发生置换反应,金属锌将Ni2+置换出来,生成Ni单质;
(4)“过滤Ⅱ”所得滤液中含有Zn2+,滴加Na2CO3溶液后生成ZnCO3沉淀,反过来,向Na2CO3溶液中滴加含有Zn2+的溶液时,由于CO32-水解使溶液显碱性,据此分析;
(5)检验沉淀是否洗涤干净,就是检验沉淀上是否含有某些可溶性的离子。
(1)升高温度、适当增加硫酸溶液的浓度、搅拌等都可使反应速率加快;
(2)将“反应Ⅰ”溶液的pH控制在5左右,高锰酸钾可将Mn2+氧化为MnO2沉淀,离子方程式为:2MnO4-+3Mn2++2H2O=5MnO2↓+4H+;
(3)加入过量的Zn粉后,金属锌将Ni2+置换出来,生成Ni单质,因此“过滤Ⅱ”所得滤渣的成分为Zn和Ni;
(4)向Na2CO3溶液中滴加含有Zn2+的溶液时,由于CO32-水解使溶液显碱性,水解生成的OH-与滴入的含有Zn2+的溶液结合,生成Zn(OH)2,因此沉淀除了ZnCO3外,还含有Zn(OH)2;
(5)检验沉淀是否洗涤干净,可取最新得到的洗涤滤液少许,先滴加盐酸酸化,再滴加BaCl2溶液,若无沉淀生成,说明洗涤干净。

 名校课堂系列答案
名校课堂系列答案【题目】下列实验能达到目的的是( )
选项 | 目的 | 实验 |
A | 检验某品牌食盐是否为加碘盐 | 将样品溶解后滴加淀粉溶液 |
B | 检验补铁剂硫酸亚铁片是否部分氧化 | 取样品溶解于水,滴加铁氰化钾溶液 |
C | 鉴别葡萄糖溶液和蔗糖溶液 | 分别取样,滴加银氨溶液,水浴加热 |
D | 证明 | 将 |
A. AB. BC. CD. D