题目内容
由下列①、②两条信息,结合学过的知识回答问题. 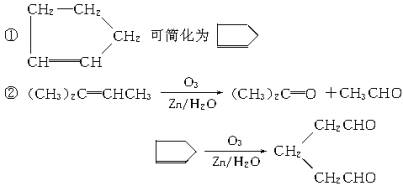
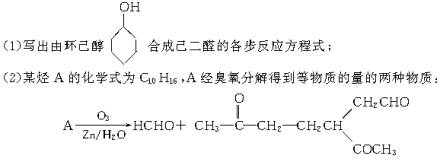
若A分子中含有六元碳环,则A的结构简式为___________.
答案:
解析:
解析:
| 解析:(1)顺利完成银镜反应的实验,必须使用洁净的试管,已用过的试管,要先在NaOH(aq)中煮沸,以洗去油污,然后再用蒸馏水洗涤.
(2)配制银氨溶液,有两点要求:①沉淀(AgOH和Ag2O的混合物)必须完全消失,否则影响实验效果;②氨水不可过量,否则产生易爆物质.因此,一般做法为:向AgNO3(aq)中滴加氨水,边滴边振荡,直到沉淀刚刚消失为止.开始时AgNO3(aq)过量,发生如下反应: ①Ag++NH3·H2O 并有部分AgOH发生分解反应(此反应不作要求): ②2AgOH 后来NH3·H2O过量,AgOH和Ag2O溶解在NH3·H2O中: ③AgOH+2NH3·H2O ④Ag2O+4NH3·H2O ④反应不作要求.注意络合物2Ag(NH3)2OH在水中完全电离,写离子方程式时须拆为离子形式. (3)银镜反应要求水浴加热才能顺利完成. 答案:(1)NaOH (2)AgNO3 氨水 生成的沉淀恰好溶解 ①Ag++NH3·H2O (3)水浴 CH3CHO+2〔Ag(NH3)2〕++2OH-→CH3COO-+NH
|

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目



