题目内容
 石灰石(主要成分为CaCO3)是重要的工业原料,
石灰石(主要成分为CaCO3)是重要的工业原料,(1)某CaCO3样品中含有少量Al2O3杂质,请设计实验方案检验该样品中的Al2O3.
限选实验试剂:2mol?L-1 HCl溶液、lmoL?L-1NaOH.0.01mol?L-1KMnO4溶液、0.1moL?L-1AgNO3溶液、燕馏水.
试补充实验步骤和预期现象:取少量粉碎后的样品装入试管中,向试管
(2)为测定样品中碳酸钙的质量分数,实验小组设计如下图部分装II(图中夹持仪器略去)进行实验,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数.
①请在方框内补充仪器和试剂,使实验装置完整.
②某同学设计测定装置C在吸
收CO2前后的质量差来确定
碳酸钙的质量分数.你认为该同学的方法是否可行?
(3)为了研究在室温条件下
CaCO3与盐酸的反应速率与c(H+)浓度关系,设计实验方案:在不同盐酸浓度下,测定生成相同体积CO2所需要的时间.
实验仪器任选,所需药品:2moL?L-1HCI溶液(密度约为1g/mL),蒸馏水.
拟定以下表格,请补充填写实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据不能用数值表示时可用字母表示).
| 物理量/单位 实验序号 | m(CaCO3)/g | V(2mon?L-1HCl)/mL | V(H2O)/mL | |
| 1 | P | 20 | 0 | |
| 2 | P |
考点:探究物质的组成或测量物质的含量
专题:
分析:该实验方案是测定C中生成的BaCO3沉淀质量,确定生成的二氧化碳的质量,进而以确定碳酸钙的质量分数.
实验装置中会残留部分二氧化碳,影响C中二氧化碳质量的沉淀,需要通入空气将装置内的二氧化碳完全排入C中被吸收,空气中含有二氧化碳,故应先用氢氧化钠溶液吸收,防止影响二氧化碳的测定;
(1)取少量粉碎后的样品装入试管中,向试管中加入氢氧化钠溶液,固体部分溶解说明含有氧化铝,因为氧化铝是两性氧化物能溶于氢氧化钠溶液;
(2)①空气中的二氧化碳和水蒸气会进入装置C使测定结果增大,最后需要连接装有碱石灰的U型管;
②B中的水蒸气、HCl气体会进入装置C中使得CO2称量结果偏大;
(3)在不同盐酸浓度下,测定生成相同体积CO2所需要的时间,一定质量的碳酸钙,滴入不同浓度的盐酸,全部溶解碳酸钙生成相同质量的二氧化碳气体时,所需要的时间比较富裕速率,可以设计在盐酸溶液中加入蒸馏水完成实验测定.
实验装置中会残留部分二氧化碳,影响C中二氧化碳质量的沉淀,需要通入空气将装置内的二氧化碳完全排入C中被吸收,空气中含有二氧化碳,故应先用氢氧化钠溶液吸收,防止影响二氧化碳的测定;
(1)取少量粉碎后的样品装入试管中,向试管中加入氢氧化钠溶液,固体部分溶解说明含有氧化铝,因为氧化铝是两性氧化物能溶于氢氧化钠溶液;
(2)①空气中的二氧化碳和水蒸气会进入装置C使测定结果增大,最后需要连接装有碱石灰的U型管;
②B中的水蒸气、HCl气体会进入装置C中使得CO2称量结果偏大;
(3)在不同盐酸浓度下,测定生成相同体积CO2所需要的时间,一定质量的碳酸钙,滴入不同浓度的盐酸,全部溶解碳酸钙生成相同质量的二氧化碳气体时,所需要的时间比较富裕速率,可以设计在盐酸溶液中加入蒸馏水完成实验测定.
解答:
解:该实验方案是测定C中生成的BaCO3沉淀质量,确定生成的二氧化碳的质量,进而以确定碳酸钙的质量分数.实验装置中会残留部分二氧化碳,影响C中二氧化碳质量的沉淀,需要通入空气将装置内的二氧化碳完全排入C中被吸收,空气中含有二氧化碳,故应先用氢氧化钠溶液吸收,防止影响二氧化碳的测定;
(1)取少量粉碎后的样品装入试管中,向试管中加入氢氧化钠溶液,固体部分溶解说明含有氧化铝,因为氧化铝是两性氧化物能溶于氢氧化钠溶液;
故答案为:加入lmoL?L-1NaOH固体部分溶解;
(2)①空气中的二氧化碳和水蒸气会进入装置C使测定结果增大,最后需要连接装有碱石灰的U型管,装置图为: ;
;
故答案为: ;
;
②B中的水蒸气、HCl气体会进入装置C中使得CO2称量结果偏大,故测定装置C在吸收CO2前后质量差,不可行;
故答案为:不可行;这样测得的结果会偏大,因为B中的水蒸气、HCl气体会进入装置C中使得CO2称量结果偏大.
(3)在不同盐酸浓度下,测定生成相同体积CO2所需要的时间,一定质量的碳酸钙,滴入不同浓度的盐酸,全部溶解碳酸钙生成相同质量的二氧化碳气体时,所需要的时间比较富裕速率,可以设计在盐酸溶液中加入aml蒸馏水完成实验测定,t1>t2说明浓度越大反应速率越大;
故答案为:
(1)取少量粉碎后的样品装入试管中,向试管中加入氢氧化钠溶液,固体部分溶解说明含有氧化铝,因为氧化铝是两性氧化物能溶于氢氧化钠溶液;
故答案为:加入lmoL?L-1NaOH固体部分溶解;
(2)①空气中的二氧化碳和水蒸气会进入装置C使测定结果增大,最后需要连接装有碱石灰的U型管,装置图为:
 ;
;故答案为:
 ;
;②B中的水蒸气、HCl气体会进入装置C中使得CO2称量结果偏大,故测定装置C在吸收CO2前后质量差,不可行;
故答案为:不可行;这样测得的结果会偏大,因为B中的水蒸气、HCl气体会进入装置C中使得CO2称量结果偏大.
(3)在不同盐酸浓度下,测定生成相同体积CO2所需要的时间,一定质量的碳酸钙,滴入不同浓度的盐酸,全部溶解碳酸钙生成相同质量的二氧化碳气体时,所需要的时间比较富裕速率,可以设计在盐酸溶液中加入aml蒸馏水完成实验测定,t1>t2说明浓度越大反应速率越大;
故答案为:
| 物理量/单位 实验序号 | 固体全部溶解的时间/min | |||
| 1 | 20 | 0 | t1 | |
| 2 | 20 | a | t2 |
点评:本题考查学生对实验原理及装置理解、对操作的评价、物质含量的测定、化学计算等,难度中等,根据物质的化学性质,要认真分析,把握实验设计的每个步骤中的实验目的,

练习册系列答案
相关题目
下列实验装置或操作正确的是( )
A、 烧杯中通入过量的CO2,出现白色沉淀,则溶液中一定含有AlO2- 烧杯中通入过量的CO2,出现白色沉淀,则溶液中一定含有AlO2- |
B、 装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、氧化性 装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、氧化性 |
C、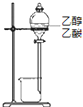 装置可以除去乙醇中的乙酸 装置可以除去乙醇中的乙酸 |
D、 装置可以比较碳酸钠、碳酸氢钠的热稳定性 装置可以比较碳酸钠、碳酸氢钠的热稳定性 |
 高铁酸盐在能源环保领域有广泛用途.用镍(Ni),铁做电极电解浓氢氧化钠溶液制备Na2FeO4的装置如图,说法合理的是( )
高铁酸盐在能源环保领域有广泛用途.用镍(Ni),铁做电极电解浓氢氧化钠溶液制备Na2FeO4的装置如图,说法合理的是( )| A、镍是阳极,电极反应4OH--4e-=2H2O+O2↑ |
| B、电解时电流方向:负极→镍电极→溶液→铁电极→正极 |
| C、若隔膜是阴离子交换膜,则OH-自右向左移动 |
| D、电解时阳极区pH降低,阴极区pH升高,撤去隔膜后与原溶液比较pH降低(假设电解前后体积变化忽略不计) |
将1mol两种气态烃组成的混合气体完全燃烧后得到1.5mol CO2和2mol H2O,下列说法正确的是( )
| A、一定有乙烷 |
| B、一定有甲烷 |
| C、一定没有甲烷 |
| D、不一定有甲烷 |
 国庆期间对大量鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,说法正确的是( )
国庆期间对大量鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,说法正确的是( )| A、分子式C15H21O4 |
| B、既能发生加聚反应,又能发生缩聚反应 |
| C、分子中有两个手性碳原子 |
| D、既能使氯化铁溶液发生显色反应,又能使酸性高锰酸钾溶液褪色 |
 已知:NH2COO-+2H2O?HCO3-+NH3?H2O.现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示.以下分析正确的是( )
已知:NH2COO-+2H2O?HCO3-+NH3?H2O.现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示.以下分析正确的是( )| A、无法判断T1和T2的大小关系 |
| B、T1℃时,第6min反应物转化率为6.25% |
| C、T2℃时,0~6min ν(NH2COO-)=0.3mol?L-1?min-1 |
| D、往平衡体系加水稀释,平衡右移,溶液中各种离子浓度减小 |
