题目内容
在2L恒容密闭容器中发生反应:2A(g)+B(g) 2C(g),若最初加入的A和B都是4mol,10 s后反应达到平衡,此时间段A的平均反应速率是0.12mol·L-1·s-1,则平衡后,容器中B的物质的量浓度为
2C(g),若最初加入的A和B都是4mol,10 s后反应达到平衡,此时间段A的平均反应速率是0.12mol·L-1·s-1,则平衡后,容器中B的物质的量浓度为
 2C(g),若最初加入的A和B都是4mol,10 s后反应达到平衡,此时间段A的平均反应速率是0.12mol·L-1·s-1,则平衡后,容器中B的物质的量浓度为
2C(g),若最初加入的A和B都是4mol,10 s后反应达到平衡,此时间段A的平均反应速率是0.12mol·L-1·s-1,则平衡后,容器中B的物质的量浓度为 [ ]
A.2.8 mol·L-1
B.1.4 mol·L-1
C.3.2 mol·L-1
D.3.6 mol·L-1
B.1.4 mol·L-1
C.3.2 mol·L-1
D.3.6 mol·L-1
B

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
气体A、B在2L恒容密闭容器中发生反应:4(g)+B(g)?2C(g),4s末时,测得n(A)=0.5 mol,n(B)=0.4mol,n(C)=0.2mol.用A浓度的减少来表示该反应的速率为( )
T0C时在2L恒容密闭容器中使X (g)与Y (g)发生反应生成Z (g)反应过程中X、Y、Z的物质的量变化如图1所示.若保持其他条件不变,温度分别为T1和T2时,X的体积分数与时间的关系如图2所示.则下列结论正确的是( )


| A、容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) | B、3min内,用Y表示的反应速率v(Y)=0.2mol/(L?min) | C、保持其他条件不变,升髙温度,化学平衡常数K增大 | D、保持其他条件不变,平衡后,增大体系压强,正反应速率增大,逆反应速率减小 |
一定温度下,在2L恒容密闭容器中发生反应:2N2O5(g)  4NO2(g)+ O2(g),△H﹥0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是
4NO2(g)+ O2(g),△H﹥0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是
| A.10min时,反应达到平衡 |
| B.该温度下反应的平衡常数为8 |
| C.0~20min内平均反应速率v(N2O5)=0.05mol?L-1?min-1 |
| D.曲线a表示NO2的物质的量随反应时间的变化 |
氮有多种氧化物,其中N2O5是一种新型硝化剂,其性质和制备收到人们的关注。
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)
 4NO2(g)+O2(g) ;⊿H>0
4NO2(g)+O2(g) ;⊿H>0
①反应达到平衡后,若再通入一定量氩气,则N2O5的转化率将___(填“增大”、“减小”、“不变”)。
②下表为反应在T1温度下的部分实验数据:
|
t/s |
0 |
500 |
1000 |
|
c(N2O5)/mol·L—1 |
5.00 |
3.52 |
2.48 |
则500s内N2O5的分解速率为______________。
③一定温度下,在2L恒容密闭容器中加入2mol
N2O5,达到平衡时,气体的压强为原来的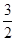 ,(不考虑NO2聚合成N2O4),则N2O5的转化率a1= ,该温度下反应的平衡常数K=_______。
,(不考虑NO2聚合成N2O4),则N2O5的转化率a1= ,该温度下反应的平衡常数K=_______。
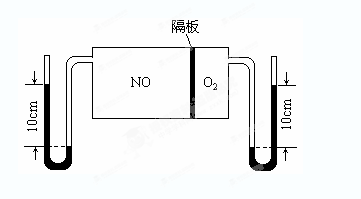
(2)如图所示装置可用于制备N2O5,则N2O5在电解池的__________区生成,其电极反应式为_________________________________。

(3)如图:V(NO):V(O2)=3:1。当抽去NO和O2之间的隔板后,NO和O2反应后成NO2,部分NO2聚合成N2O4(N2O4此时为气态)。当体系达到平衡后,U形毛细管两端汞面高度差由反应前10cm变为7.1cm。假设温度不变,且隔板及U形毛细管的体积都忽略不计,此时混合气体的平均相对分子质量为__________。