题目内容
 电化学与生产生活密切相关.
电化学与生产生活密切相关.(1)如图甲是一个电化学装置示意图.
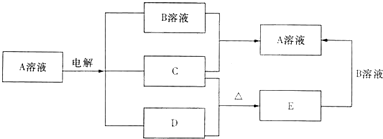
①如果A为含有锌、银、金等杂质的粗铜,B为纯铜,C为CuSO4通电一段时间后,A极减少的质量将
②如果A是铂电极,B是石墨电极,C是氯化钠溶液,用氢氧燃料电池做电源,制得11.2L(标准状况)Cl2时,该燃料电池理论上需消耗 H2的物质的量为
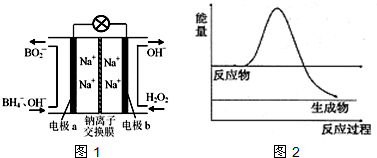
(2)利用图乙装置模拟铁的电化学防护.若X为碳棒,为减缓铁的腐蚀,开关K应置于
(3)工业上采用电解的方法来制取活泼金属铝.写出电解反应方程式:
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)①根据转移电子守恒分析;
②根据电子守恒计算生成气体的物质的量和反应氢气的物质的量关系;
(2)作原电池正极或作电解池阴极的金属被保护;
(3)工业上通过电解氧化铝知Al,据此书写电解反应式.
②根据电子守恒计算生成气体的物质的量和反应氢气的物质的量关系;
(2)作原电池正极或作电解池阴极的金属被保护;
(3)工业上通过电解氧化铝知Al,据此书写电解反应式.
解答:
解:(1)①阳极上金属锌、铜都失电子发生氧化反应,阴极上铜离子得电子发生还原反应而析出铜,根据转移电子守恒知,A电极上质量减少的量大于B极质量增加的量,故答案为:大于;
②生成11.2L氯气转移电子的物质的量=
=1mol,根据串联电路中转移电子守恒知,消耗氢气的物质的量=
=0.5 mol,故答案为:0.5;
(2)作原电池正极或作电解池阴极的金属被保护,若X为碳棒,为减缓铁的腐蚀,则铁应作电解池阴极,所以开关K应该置于处N处;
若X为锌,开关K置于M处,该装置构成原电池,锌易失电子作负极,铁作正极而被保护,该电化学防护法称为牺牲阳极的阴极保护法,
故答案为:N;牺牲阳极的阴极保护法;
(3)工业上电解氧化铝的电解反应式为:
2Al2O3
2Al+3O2↑,故答案为:2Al2O3
2Al+3O2↑.
②生成11.2L氯气转移电子的物质的量=
| 11.2L |
| 22.4L/mol |
| 1mol |
| 2 |
(2)作原电池正极或作电解池阴极的金属被保护,若X为碳棒,为减缓铁的腐蚀,则铁应作电解池阴极,所以开关K应该置于处N处;
若X为锌,开关K置于M处,该装置构成原电池,锌易失电子作负极,铁作正极而被保护,该电化学防护法称为牺牲阳极的阴极保护法,
故答案为:N;牺牲阳极的阴极保护法;
(3)工业上电解氧化铝的电解反应式为:
2Al2O3
| ||
| ||
点评:本题考查了电解精炼金属、电子守恒的应用、金属的电化学保护、电解反应方程式的书写,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目