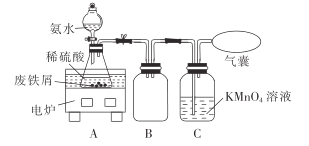
题目内容
【题目】高温下,某反应达平衡,平衡常数K=c(CO)c(H2O)/c(CO2)c(H2),恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A.该反应的ΔH>0
B.恒温恒容条件下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2O![]() CO2+H2
CO2+H2
【答案】A
【解析】
A、恒容时,温度升高,H2的浓度减小,说明平衡向正反应移动,该反应正反应为吸热反应,即反应的焓变为正值,△H>0,故A正确;
B、恒温恒容时,增大氢气的浓度,增大压强,平衡向正反应移动,平衡时氢气的浓度增大,故B错误;
C、升高温度,反应物、生成物的活化分子增多,正、逆反应速率都增大,故C错误;
D、平衡常数K= ,可知该可逆反应为CO2(g)+H2(g)CO(g)+H2O(g),故D错误;
,可知该可逆反应为CO2(g)+H2(g)CO(g)+H2O(g),故D错误;
故选:A。

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
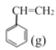
【题目】苯乙烯是一种重要的化工原料。工业中以乙苯![]() 为原料,采用催化脱氢的方法制取苯乙烯
为原料,采用催化脱氢的方法制取苯乙烯![]() 。回答下列问题:
。回答下列问题:
己知:①![]()
![]()
 +H2(g) △H1>0
+H2(g) △H1>0
②![]() △H2>0
△H2>0
(1)![]() +CO2(g)
+CO2(g)![]()
![]() +CO(g)+H2O(g) △H=_______,(用△H 1、△H 2表示)有利于提高己苯平衡转化率的条件是____(填标号)。
+CO(g)+H2O(g) △H=_______,(用△H 1、△H 2表示)有利于提高己苯平衡转化率的条件是____(填标号)。
a 高温 b 高压 c 低温 d 低压
(2)已知T1℃下,将1mol乙苯蒸气通入到体积为2L的密闭容器中进行反应①,容器内气体总物质的量随反应时间的变化情况如下表所示:
时间t/min | 0 | 10 | 20 | 30 | 40 |
总物质的量n/mol | 1.0 | 1.4 | 1.65 | 1.8 | 1.8 |
①由表中数据计算0~10min内v(H2)=____:平衡时乙苯的转化率为____
②T1℃下该反应的平衡常数K1=____
③若温度T1℃下的平衡常数K小于T2℃下的平衡常数K2,则T1____T2(填“>”、 “<”或“=”)