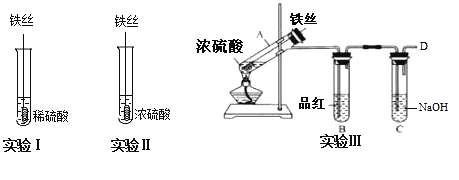
题目内容
【题目】FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
【查阅资料】1、无水FeCl3在空气中易潮解,加热易升华。
2、氯气(Cl2)是一种有毒的黄绿色气体,能与NaOH溶液反应。
【实验探究】学习小组设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
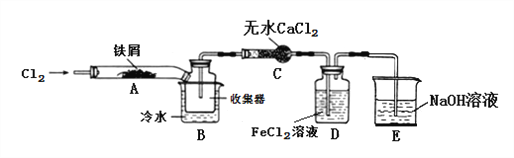
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为:______________。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作是:____________。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填操作步骤序号)____________。
(4)装置D中FeCl2溶液全部反应后,因失去吸收Cl2的作用而失效,写出证明FeCl2溶液已经失效的操作方法:________________。
(5)该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到黄色固体。请写出该反应的离子方程式:__________________。
【答案】2Fe+3Cl2 ![]() 2FeCl3在沉积的FeCl3固体下方加热②⑤取待证明的溶液2mL,滴入1~2滴酸性KMnO4溶液,如果溶液变为红色,证明FeCl2溶液已经失效。2Fe3++H2S=2Fe2++S↓+2H+
2FeCl3在沉积的FeCl3固体下方加热②⑤取待证明的溶液2mL,滴入1~2滴酸性KMnO4溶液,如果溶液变为红色,证明FeCl2溶液已经失效。2Fe3++H2S=2Fe2++S↓+2H+
【解析】试题分析:装置A中铁与氯气反应生成氯化铁,B中的冷水作用是冷却FeCl3使其沉积,便于收集产品;为防止外界空气中的水蒸气进入装置使FeCl3潮解,所以用装置C无水氯化钙来吸水,装置D中用FeCl2吸收Cl2生成氯化铁,用装置D中的副产品FeCl3溶液吸收H2S,用氢氧化钠溶液吸收的是氯气,不用考虑防倒吸,所以装置E为氢氧化钠溶液吸收氯气,据此分析解答。
解析:(1)氯气具有强氧化性,将变价铁氧化成高价铁,生成氯化铁,所以装置A中铁与氯气反应生成氯化铁,反应的方程式为2Fe+3Cl2 ![]() 2FeCl3 ;
2FeCl3 ;
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,第④步操作是对FeCl3加热发生升华使沉积的FeCl3进入收集器;
(3)为防止FeCl3潮解所采取的措施有②通入干燥的Cl2;⑤用干燥的N2赶尽Cl2,答案选②⑤;
(4)检验FeCl2是否失效应检验FeCl2是否存在,可以用KMnO4溶液检验,即取待证明的溶液2mL,滴入1~2滴酸性KMnO4溶液,如果溶液变为红色,证明FeCl2溶液已经失效;
(5)三价铁具有氧化性,硫化氢具有还原性,二者之间发生氧化还原反应2Fe3++H2S=2Fe2++S↓+2H+。

【题目】对下列实验现象的解释不正确的是( )
选项 | 实验现象 | 解释 |
A | Cl2使鲜艳的红色花瓣褪色 | Cl2具有强还原性 |
B | NH3与HCl气体接触时有白烟产生 | NH3与HCl反应生成NH4Cl固体小颗粒 |
C | 新切开的Na表面在空气中很快变暗 | Na容易与空气中的氧气等反应 |
D | 加热铝箔时熔化的Al不滴落 | Al表面的氧化膜熔点高,包在熔化的Al外面 |
A. A B. B C. C D. D
【题目】研究CO、NOx、SO2等的处理方法对环境保护有重要意义。
(1)科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H=-746.8kJ·mol-1
2CO2(g)+N2(g) △H=-746.8kJ·mol-1
①为了研究外界条件对该反应的影响,进行下表三组实验,测得不同时刻NO的浓度(c)随时间变化的趋势如图1所示。1、2、3代表的实验编号依次是___________。(已知在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。)
实验 编号 | 温度 (℃) | NO初始浓度(mol·L-1) | CO初始浓度 (mol·L-1) | 催化剂比表面积(m2·g-1) | 催化剂用量(g) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 | 50 |
Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 | 50 |
Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 | 50 |
②图2表示NO的平衡转化率(α)随温度、压强变化的示意图。X表示的是__________,理由是________;Y表示的是________,且Y1________Y2(填“>”或“<”)。

(2)一定温度下,将NO2与SO2以体积比1:2置于密闭容器中发生反应NO2(g)+SO2(g)![]() SO3(g)+NO(g),达到平衡时SO3的体积分数为25%。该反应的平衡常数K=_______。
SO3(g)+NO(g),达到平衡时SO3的体积分数为25%。该反应的平衡常数K=_______。
(3)利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3![]() 7N2+12H2O,电解质溶液为碱性。工作一段时间后,该电池负极区附近溶液pH________(填“变大”、“变小”或“不变”),正极电极反应式为_______。
7N2+12H2O,电解质溶液为碱性。工作一段时间后,该电池负极区附近溶液pH________(填“变大”、“变小”或“不变”),正极电极反应式为_______。