题目内容
【题目】A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图1。E原子最外层电子数是D原子最外层电子数的4倍,D的简单离子核外电子排布与C2-相同。

试回答:
(1)元素E在元素周期表中的位置是________。
(2)与元素D的简单离子所含电子数和质子数均相同的微粒是________(用化学式作答,下同)。
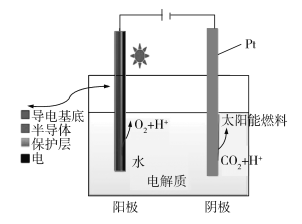
(3)B和E的最高价氧化物对应的水化物,酸性较弱的为________。若用上图2中装置验证这两种酸的酸性强弱,则在装置中加入的试剂分别为:Ⅰ________Ⅱ________,观察到的实验现象是____。
(4)由以上五种元素组成的中学常见的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A、C、D的盐 |
b | C、D组成的化合物,且原子个数之比为1∶1 |
c | 化学组成为AC2 |
①a含有的化学键有____________________________________;
②c的电子式为___________________;
③b与c反应的化学方程式为____________________________________。
【答案】第三周期ⅣA族 NH![]() H2SiO3 HNO3 Na2SiO3 Ⅱ中出现白色胶状沉淀 离子键、共价键
H2SiO3 HNO3 Na2SiO3 Ⅱ中出现白色胶状沉淀 离子键、共价键 ![]() 2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2CO2=2Na2CO3+O2
【解析】
A、B、C、D、E为原子序数依次增大的短周期主族元素,E原子最外层上的电子数是D原子最外层电子数的4倍,则D处于IA族,E处于ⅣA族,E与A最外层电子数相同,二者同主族,且E的原子半径较大,故A为碳元素、E为Si;最外层电子数C>B>4,且二者原子半径小于碳原子,故B、C处于第二周期,C能形成离子C2-,故C为O元素,则B为N元素;D离子核外电子排布与O2-相同,且D处于IA族,故D为Na,据此解答。
(1)元素E为Si,在元素周期表中的位置是:第三周期ⅣA族;
(2)元素D离子为Na+,与Na+所含电子数和质子数均相同的微粒是:NH4+(或H3O+);
(3)B和E最高价氧化物对应的水化物分别为HNO3、H2SiO3,酸性较弱的为H2SiO3,若验证这两种酸的酸性强弱,根据强酸制弱酸的原理,则在装置中加入的试剂分别为:Ⅰ为HNO3,Ⅱ为Na2SiO3,发生反应:2HNO3+ Na2SiO3= H2SiO3↓+2NaNO3,现象为:Ⅱ中出现白色胶状沉淀,故答案为:HNO3;Na2SiO3;中出现白色胶状沉淀;
(4) 由以上五种元素组成的中学常见物质,a是含有C、O、Na的盐,则a为Na2CO3,c的化学组成为AC2,则c为CO2,b是O、Na组成的化合物,且原子数之比为1:1,则b为Na2O2,
①a为Na2CO3,含有离子键、共价键;
②c的电子式为![]() ;
;
③b与c反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2。

【题目】下列反应属于氧化还原反应的是( )
A. SO3+ H2O= H2SO4 B. NH4Cl ![]() NH3
NH3![]() +HCl
+HCl![]()
C. Fe+CuSO4= FeSO4+Cu D. NaOH+HNO3=NaNO3+H2O
【题目】下表中对应关系正确的是
A | CH3CH3+Cl2 | 均为取代反应 |
B | 由油脂得到甘油 | 均发生了水解反应 |
C | Cl2+2Br=2Cl+Br2 | 均为单质被还原的置换反应 |
D | 2Na2O2+2H2O+4NaOH+O2↑ | 均为水作还原剂的氧化还原反应 |
【题目】某兴趣小组为探究温度、压强对可逆反应A(g)+B(g) ![]() C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1 mol A和1 mol B,反应达平衡时测得容器中各物质的量浓度为[浓度1]。然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强;分别测得新平衡时容器中各物质的量浓度为[浓度2]、[浓度3]。请找出实验操作①②与实验数据[浓度2]、[浓度3]的对应关系,并分析下列结论,其中错误的是
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1 mol A和1 mol B,反应达平衡时测得容器中各物质的量浓度为[浓度1]。然后改变外界条件又做了两组实验:①只升高温度;②只改变体系压强;分别测得新平衡时容器中各物质的量浓度为[浓度2]、[浓度3]。请找出实验操作①②与实验数据[浓度2]、[浓度3]的对应关系,并分析下列结论,其中错误的是
A | B | C | |
浓度1 | 0.05 mol·L-1 | a mol·L-1 | 0.05 mol·L-1 |
浓度2 | 0.078 mol·L-1 | 0.078 mol·L-1 | 0.022 mol·L-1 |
浓度3 | 0.06 mol·L-1 | 0.06 mol·L-1 | 0.04 mol·L-1 |
浓度4 | 0.07 mol·L-1 | 0.07 mol·L-1 | 0.098 mol·L-1 |
A. 由[浓度3]与[浓度1]的比较,可判断平衡移动的原因是增大了体系的压强
B. 由[浓度2]与[浓度1]的比较,可判断正反应是放热反应
C. [浓度1]中a=0.05
D. 该组某学生在实验①过程中,测得各物质在某一时刻的浓度为[浓度4]。与[浓度1]比较,可发现该同学在测定[浓度4]这组数据时出现了很大的误差