题目内容
【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
(1)Ⅰ.以H2O2的分解反应为研究对象,实验方案与数据记录如表,t表示收集a mL O2所需的时间:
序号 | 反应 | c(H2O2)/ | V(H2O2) | m(MnO2) | t/min |
1 | 20 | 2 | 10 | 0 | t1 |
2 | 20 | 2 | 10 | 0.1 | t2 |
3 | 20 | 4 | 10 | 0.1 | t3 |
4 | 40 | 2 | 10 | 0.1 | t4 |
a.设计实验2和实验3的目的是研究对化学反应速率的影响;
b.为研究温度对化学反应速率的影响,可以将实验和实验作对比(填序号);
c.将实验1和实验2作对比,t1t2(填“>”、“<”或“=”).
(2)Ⅱ.以KI和FeCl3反应为例(2Fe3++2I﹣2Fe2++I2)设计实验,探究此反应存在一定的限度.可选试剂:
①0.1molL﹣1KI溶液②0.1molL﹣1 FeCl3溶液③0.1molL﹣1 FeCl2溶液
④0.1molL﹣1盐酸⑤0.1molL﹣1KSCN溶液⑥CCl4
实验步骤:
a.取5mL 0.1molL﹣1 KI溶液,再滴加几滴0.1molL﹣1 FeCl3溶液;
b.充分反应后,将溶液分成三份;
c.取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘;
d.另取一份,加试剂(填序号),现象,说明此反应存在一定的限度.
(3)Ⅲ.N2O4可分解为NO2 . 在100mL密闭容器中投入0.01mol N2O4 , 利用现代化学实验技术跟踪测量c(NO2).c(NO2)随时间变化的数据记录如图所示: 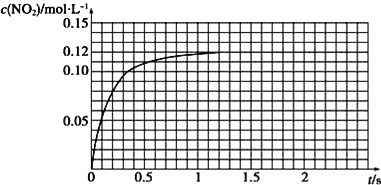
a.反应容器中最后剩余的物质有 , 其中N2O4的物质的量为mol;
b.c(NO2)随时间变化的曲线表明,实验测得的化学反应速率在逐渐减小,最后 . (选填“变大”,“变小”或“不变”)
【答案】
(1)H2O2的浓度;2;4;>
(2)⑤;溶液出现血红色
(3)NO2、N2O4;0.004mol;不变
【解析】解:Ⅰ.(1)实验2和实验3主要是双氧水的浓度不同,则实验目的为研究双氧水浓度不同,对化学反应速率的影响,所以答案是:H2O2的浓度;(2)实验2和实验4其他条件都相同,只有温度不同,所以答案是:2;4;(3)试验1和实验2相比较,2中使用了催化剂,其他条件相同,反应速率大,所用时间短,所以答案是:>;Ⅱ.(4)加入0.1molL﹣1 KSCN溶液,如果溶液出现血红色,说明溶液中有没反应的FeCl3溶液,说明此反应为可逆反应,存在一定的限度,所以答案是:⑤;溶液出现血红色;Ⅲ.(1)因为N2O4(g)2NO2为可逆反应,反应达平衡时,反应容器中最后剩余的物质有NO2、N2O4;平衡时,n(NO2)=0.12mol/L×0.1L=0.012mol,则N2O4的物质的量为0.01mol﹣0.006mol=0.004mol,所以答案是:NO2、N2O4;0.004mol;(2)达到平衡状态时,正反应速率与逆反应速率相等,保持不变,所以答案是:不变.

【题目】化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率。

(1)除如图装置所示的实验用品外,还需要的一件实验用品是______________。
(2)圆底烧瓶中所发生反应的离子方程式为___________。
(3)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是____________________________________。
(4)利用该化学反应,试简述测定反应速率的其他方法:________________(写一种)。
Ⅱ.探究化学反应速率的影响因素
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表。(已知 I2+2 Na2S2O3=== Na2S4O6+2 NaI,其中Na2S2O3溶液均足量)
实验序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | T1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | T2 |
③ | 6.0 | 2.0 | 4.0 | Vx | T3 |
(5)表中Vx=__________mL,T1、T2、T3的大小关系是____________________________。
【题目】【2017硚口区校级模拟】某兴趣小组为探究外界条件对可逆反应A(g)+B(g)═C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ.然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ.
A | B | C | |
Ⅰ | 0.050molL﹣1 | 0.050molL﹣1 | 0.050molL﹣1 |
Ⅱ | 0.070molL﹣1 | 0.070molL﹣1 | 0.098molL﹣1 |
Ⅲ | 0.060molL﹣1 | 0.060molL﹣1 | 0.040molL﹣1 |
Ⅳ | 0.080molL﹣1 | 0.080molL﹣1 | 0.12molL﹣1 |
针对上述系列实验,下列结论中错误的是( )
A.由Ⅰ中数据可计算出该温度下反应的平衡常数K=20mol﹣1L
B.Ⅱ可能是通过增大C的浓度实现的
C.若Ⅲ只是升高温度,则与Ⅰ比较,可以判断出正反应一定是放热反应
D.第Ⅳ组实验数据的得出,只能通过压缩容器的体积才可以实现