题目内容
10.短周期元素A、B、C、D、E在元素周期表中的相对位置如图所示,下列说法正确的( )
| A. | 原子半径的大小顺序为:rA>rB>rC>rD>rE | |
| B. | 元素D的最高价氧化物对应的水化物的酸性比E的强 | |
| C. | A、D两种元素在自然界中都存在相应的单质 | |
| D. | C的最高价氧化物的水化物与E的最高价氧化物的水化物之间不能发生反应 |
分析 短周期元素A、B、C、D、E在元素周期表中的相对位置可知,AB在第二周期,CDE在第三周期,根据元素在周期表中位置可知,A为N元素,B为O元素,C为Al元素,D为S元素,E为Cl元素;
A.电子层数越多,半径越大,电子层数相同时,原子序数越大,半径越小;
B.同周期从左到右非金属性逐渐增强,其最高价氧化物对应的水化物的酸性增强;
C.N、S在自然界中存在单质;
D.C为Al元素,其最高价氧化物的水化物为两性氢氧化物,E为Cl元素,其最高价氧化物的水化物为强酸.
解答 解;短周期元素A、B、C、D、E在元素周期表中的相对位置可知,AB在第二周期,CDE在第三周期,根据元素在周期表中位置可知,A为N元素,B为O元素,C为Al元素,D为S元素,E为Cl元素;
A.电子层数越多,半径越大,电子层数相同时,原子序数越大,半径越小,则原子半径的大小顺序为:rC>rD>rE>rA>rB;故A错误;
B.同周期从左到右非金属性逐渐增强,其最高价氧化物对应的水化物的酸性增强,则元素D的最高价氧化物对应的水化物的酸性比E的弱,故B错误;
C.N、S在自然界中存在单质,分别为氮气和硫磺,故C正确;
D.C为Al元素,其最高价氧化物的水化物为两性氢氧化物,E为Cl元素,其最高价氧化物的水化物为强酸,二者能发生反应,故D错误.
故C.
点评 本题考查了元素周期表的结构和元素性质的应用,题目难度不大,注意根据元素在周期表中的位置判断出具体的元素,再结合元素周期律解答.

练习册系列答案
 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
相关题目
20.Te(碲)元素位于是第5周期ⅥA族,根据同族元素的性质推断,碲不可能具有的性质是( )
| A. | Te与H2的反应比S与H2反应困难 | B. | TeO3对应的水化物是一种酸 | ||
| C. | H2Te的还原性比H2S弱 | D. | 有-2、+4、+6三种化合价 |
1.下列关于周期表中有关族的叙述,正确的是( )
| A. | I A族元素又称为碱金属元素 | |
| B. | 副族和Ⅷ族中的元素均为过渡元素 | |
| C. | 族的序数都等于该族元素原子的最外层电子数 | |
| D. | 元素周期表中每个纵列为一族,共有18个族 |
18.有硫酸酸化的草酸(H2C2O4,二元弱酸)溶液能将KMnO4溶液中的MnO4-转化为Mn2+.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常 温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,完成以下实验设计表.
(2)该反应的离子方程式5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
(3)若t1<t2,则根据实验①和②得到的结论是溶液的pH对该反应的速率有影响.
(4)请你设计实验验证MnSO4对该反应起催化作用,完成下表中内容.
(5)化学小组滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O4•2H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定次,平均消耗KMnO4溶液VmL.滴定到达终点的现象是:滴入一滴KMnO4溶液,溶液呈浅红色,且30秒内不褪色;实验中所需的定量仪器有托盘天平、250mL容量瓶、(酸式)滴定管(填仪器名称).该KMnO4溶液的物质的量浓度为$\frac{20a}{63V}$mol/L.
(1)常 温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,完成以下实验设计表.
| 实验 编号 | 温度 | 初始pH | 0.1mol/L草酸溶液/mL | 0.01mol/LKMnO4溶液体积/mL | 蒸馏水 体积/mL | 待测数据(反应混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | 50 | 10 | t3 |
(3)若t1<t2,则根据实验①和②得到的结论是溶液的pH对该反应的速率有影响.
(4)请你设计实验验证MnSO4对该反应起催化作用,完成下表中内容.
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
往反应混合液中加入少量MnSO4固体,控制其他反应条件与实验①相同,进行对比实验 | 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
15.元素中最高正价与负价绝对值的差等于6的是( )
| A. | N | B. | S | C. | F | D. | Cl |
2.下列物质中一定互为同系物的是( )
①CH4 ②C3H6 ③C8H18 ④CH2=CHCH2CH3 ⑤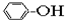 ⑥
⑥ ⑦
⑦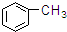 ⑧
⑧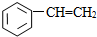
①CH4 ②C3H6 ③C8H18 ④CH2=CHCH2CH3 ⑤
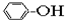 ⑥
⑥ ⑦
⑦ ⑧
⑧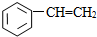
| A. | ①③ | B. | ②④ | C. | ⑤⑥ | D. | ⑦⑧ |
5.软锰矿的主要成分是二氧化锰,用软锰矿浆吸收工业废气中的二氧化硫,可以制高纯度的硫酸锰晶体,其流程如图所示:

已知:浸出液中的金属阳离子主要是Mn2+,还含有少量的Fe2+、Al3+等,且pH<2.几种离子开始沉淀和完全沉淀时的pH如右表所示:
根据上述流程,回答下列问题:
(1)写出二氧化锰与二氧化硫反应的化学方程式:SO2+MnO2═MnSO4.
(2)浸出液的pH<2,从上述流程看,可能的原因为二氧化硫溶于水发生反应:SO2+H2O=H2SO3,生成的H2SO3部分电离:H2SO3?H++HSO3-
(用化学用语和必要的文字说明).
(3)用离子方程式表示加入二氧化锰的作用:MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O.
(4)从表中数据来看,能不能取消“加入二氧化锰”的步骤?原因是pH=9.7时Fe2+才完全沉淀,而pH=8.3时Mn2+已经开始沉淀.
(5)下列试剂能替代二氧化锰的是A(填序号).
A.双氧水 B.氯水 C.高锰酸钾溶液 D.次氯酸钠
(6)有同学认为可以用碳酸锰(MnCO3)或氢氧化锰[Mn(OH)2]替代石灰乳,你是否同意此 观点?简述理由:同意,铁离子、铝离子水解程度比锰离子大,加热碳酸锰或氢氧化锰与氢离子反应,促进铁离子、铝离子水解,进而转化为沉淀,再通过过滤除去.
(7)从含硫酸锰的滤液中提取硫酸锰晶体的操作是蒸发浓缩、降温结晶;过滤.利用 废渣能提取高纯度的铁红,简述其操作过程:将滤渣溶于足量的氢氧化钠溶液中,再进行过滤、洗涤、干燥,最后灼烧可得氧化铁.

已知:浸出液中的金属阳离子主要是Mn2+,还含有少量的Fe2+、Al3+等,且pH<2.几种离子开始沉淀和完全沉淀时的pH如右表所示:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
(1)写出二氧化锰与二氧化硫反应的化学方程式:SO2+MnO2═MnSO4.
(2)浸出液的pH<2,从上述流程看,可能的原因为二氧化硫溶于水发生反应:SO2+H2O=H2SO3,生成的H2SO3部分电离:H2SO3?H++HSO3-
(用化学用语和必要的文字说明).
(3)用离子方程式表示加入二氧化锰的作用:MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O.
(4)从表中数据来看,能不能取消“加入二氧化锰”的步骤?原因是pH=9.7时Fe2+才完全沉淀,而pH=8.3时Mn2+已经开始沉淀.
(5)下列试剂能替代二氧化锰的是A(填序号).
A.双氧水 B.氯水 C.高锰酸钾溶液 D.次氯酸钠
(6)有同学认为可以用碳酸锰(MnCO3)或氢氧化锰[Mn(OH)2]替代石灰乳,你是否同意此 观点?简述理由:同意,铁离子、铝离子水解程度比锰离子大,加热碳酸锰或氢氧化锰与氢离子反应,促进铁离子、铝离子水解,进而转化为沉淀,再通过过滤除去.
(7)从含硫酸锰的滤液中提取硫酸锰晶体的操作是蒸发浓缩、降温结晶;过滤.利用 废渣能提取高纯度的铁红,简述其操作过程:将滤渣溶于足量的氢氧化钠溶液中,再进行过滤、洗涤、干燥,最后灼烧可得氧化铁.
6.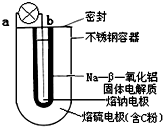 钠-硫($\frac{Na}{{S}_{8}}$)电池是由固体电解质将两个液体电极隔开(如图),一个由钠-β-氧化铝固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点119℃)隔开,并允许Na+通过.下列有关说法错误的是( )
钠-硫($\frac{Na}{{S}_{8}}$)电池是由固体电解质将两个液体电极隔开(如图),一个由钠-β-氧化铝固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点119℃)隔开,并允许Na+通过.下列有关说法错误的是( )
 钠-硫($\frac{Na}{{S}_{8}}$)电池是由固体电解质将两个液体电极隔开(如图),一个由钠-β-氧化铝固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点119℃)隔开,并允许Na+通过.下列有关说法错误的是( )
钠-硫($\frac{Na}{{S}_{8}}$)电池是由固体电解质将两个液体电极隔开(如图),一个由钠-β-氧化铝固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点119℃)隔开,并允许Na+通过.下列有关说法错误的是( )| A. | 放电时b为电池的负极 | |
| B. | 充电时阴极反应式为:Na++e-=Na | |
| C. | 充电时,阳极处发生还原反应 | |
| D. | 放电时Na+可以穿过固体电解质流向a电极 |

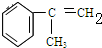 C的结构简式:
C的结构简式: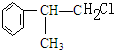 .
. +NaCl.
+NaCl.