题目内容
11.下列判断错误的是( )| A. | 沸点:HI>HBr>HCl>HF | |
| B. | 稳定性:NH3>PH3>AsH3(As与N位于同一主族) | |
| C. | 酸性:HClO4>H2SO4>H3PO4 | |
| D. | 碱性:NaOH>Mg(OH)2>Be(OH)2 |
分析 A、HF含有氢键,沸点最高,HI、HBr、HCl都不含氢键,相对分子质量越大,沸点越高;
B、元素的非金属性越强其对应的氢化物越稳定;
C、中心元素非金属性越强,最高价氧化物对应的水化物的酸性越强;
D、元素金属性越强,最高价氧化物对应的水化物的碱性越强.
解答 解:A、HF含有氢键,沸点最高,HI、HBr、HCl都不含氢键,相对分子质量越大,沸点越高,故熔沸点:HF>HI>HBr>HCl,故A错误;
B、元素的非金属性越强其对应的氢化物越稳定,非金属性:N>P>As,则稳定性:NH3>PH3>AsH3,故B正确;
C、中心元素非金属性越强,最高价氧化物对应的水化物的酸性越强,非金属性:Cl>S>P,则酸性:HClO4>H2SO4>H3PO4,故C正确;
D、元素金属性越强,最高价氧化物对应的水化物的碱性越强,金属性:Na>Mg>Be,所以碱性:NaOH>Mg(OH)2>Be(OH)2,故D正确;
故选A.
点评 本题考查物质性质的比较的比较、元素周期律的应用,难度不大,要注意基础知识的积累.

练习册系列答案
相关题目
1.戊烷的同分异构体共有( )种.
| A. | 6 | B. | 5 | C. | 4 | D. | 3 |
19.已知某元素的阳离子R2+的核内中子数为n,质量数为A,则m克它的氧化物中所含质子的物质的量是( )
| A. | $\frac{(A-n+8)m}{A+16}$mol | B. | $\frac{(A-n+10)m}{A+16}$ mol | C. | (A-n+2)mol | D. | (A-n+6)mol |
6.下列有关原子结构的说法,正确的是( )
| A. | 稀有气体元素原子的最外层电子数都是8 | |
| B. | 非金属元素的最外层电子数都大于3 | |
| C. | 金属元素的最外层电子数不都小于4 | |
| D. | 所有原子核都是由质子和中子构成的 |
20.有可能混有下列物质的13.2g (NH4)2SO4样品,将该样品在加热条件下与过量NaOH溶液反应,可收集4.3L(标况)气体,则该样品不可能含有的物质是( )
| A. | NH4HCO3和NH4NO3 | B. | (NH4)2CO3和NH4Cl | C. | NH4Cl和NH4HCO3 | D. | NH4Cl和NH4NO3 |
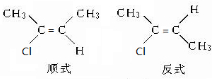 .
.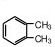 (结构简式)在苯环上的二溴代物只有两种.
(结构简式)在苯环上的二溴代物只有两种.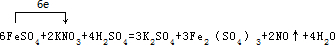 .
.