题目内容
【题目】25℃时,向体积为 10 mL 的 0.1 mol/LNaOH溶液中逐滴加入0.1mol/LCH3COOH溶液,曲线如图所示。下列有关离子浓度关系的比较中,错误的是
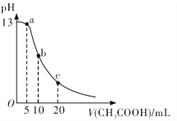
A. a点处:c( Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. b点处:c(CH3COOH)+c(H+ )=c(OH-)
C. c点处:c(CH3COOH)+c(CH3COO-)=2c(Na+)
D. NaOH溶液和CH3COOH溶液以任意比混合时:c( Na+)+c(H+)=c(OH-)+(CH3COO-)
【答案】A
【解析】A项,由图可得,a点处溶液中的溶质是等物质的量的CH3COONa和NaOH,溶液呈碱性,则c(OH-)>c(H+),又因为水和NaOH都电离出OH-,CH3COO-水解,所以溶液中c(OH-)>c(CH3COO-),故A错误;B项,b点处CH3COOH和NaOH恰好完全反应生CH3COONa,根据质子守恒可得:c(CH3COOH)+c(H+)=c(OH-),故B正确;C项,c点处溶液中的溶质是等物质的量的CH3COOH和CH3COONa,根据物料守恒得c(CH3COOH)+c(CH3COO-)=2c(Na+),故C正确;D项,NaOH溶液和CH3COOH溶液任意比混合时,根据电荷守恒可得:c(Na+)+c(H+)=c(OH-)+(CH3COO-),故D正确。

【题目】某化学小组采用如下装置用环己醇制备环己烯。
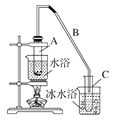
已知:环己醇和浓硫酸混合在85 ℃下制取环己烯。
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是________,导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是____________________________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在________层(填“上”或“下”),分液后用________(填入编号)洗涤。
A. KMnO4溶液 B. 稀硫酸 C. Na2CO3溶液
②再将环己烯按如图装置蒸馏,冷却水从________口进入。蒸馏时要加入生石灰,目的是__________________________________________。
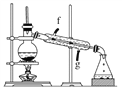
③收集产品时,控制的温度应在________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是____________。
a. 蒸馏时从70℃开始收集产品
b. 环己醇实际用量多了
c. 制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是___________;如果得实际得到产品质量为8.2 g, 则该实验的产率是_________________(保留3位有效数字)。
a. 用酸性高锰酸钾溶液 b. 用金属钠 c. 测定沸点
【题目】(1)纯净物可根据其组成和性质进行分类。如图所示的分类方法属于___________(填字母)。
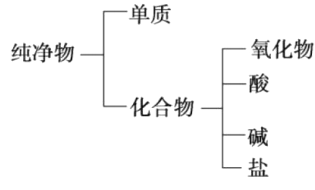
A.交叉分类法 B.树状分类法
(2)人们以______________________为分类标准分出溶液、胶体和浊液三种体系。实验室制备Fe(OH)3胶体的实验步骤是:________________________________________________________________________,请写出实验室制备Fe(OH)3胶体的化学方程式:_________________________________。
(3)以H、O、S、N几种元素中任意两种或三种元素组成合适的常见物质,分别将其中一种常见物质的化学式填在下表相应类别中:
物质类别 | 非含氧酸 | 碱 | 酸式盐 | 酸性氧化物 |
化学式 | ______ | _____ | ____ | _____ |

