题目内容
8.下列物质①C2H6 ②C3H6 ③C6H14 ④C5H8充分燃烧,等质量时产生CO2最多的、消耗O2最多的;等物质的量时消耗O2最多的、生成水最多的依次是( )| A. | ④①③① | B. | ④①③③ | C. | ④③④③ | D. | ①②④③ |
分析 等质量的烃完全燃烧,C的质量分数越大生成二氧化碳越多,H元素质量分数越大消耗氧气越多;
等物质的量的烃CxHy完全燃烧,1mol烃的耗氧量为(x+$\frac{y}{4}$)mol,分子中H原子数目越大生成的水越多.
解答 解:等质量的烃完全燃烧,C的质量分数越大生成二氧化碳越多,H元素质量分数越大消耗氧气越多,
①C2H6 ②C3H6 ③C6H14 ④C5H8,中C、H原子数目之比分别为1:3、1:2、1:2.33、1:1.6,故碳元素质量分数为:④>②>③>①,氢元素质量分数为①>③>②>④,各烃等质量充分燃烧时产生CO2最多的是④、消耗O2最多的是①;
①1molC2H6耗氧量为(2+$\frac{6}{4}$)mol=3.5mol,②1molC3H6 耗氧量为(3+$\frac{6}{4}$)mol=4.5mol,③1molC6H14 耗氧量为(6+$\frac{14}{4}$)mol=9.5mol,④1molC5H8耗氧量为(5+$\frac{8}{4}$)mol=7mol,故等物质的量时消耗O2最多的是③,各分子中C6H14 分子中H原子数目最大,故等物质的量时③C6H14 生成水的量最多,
故选:B.
点评 本题考查烃燃烧的有关计算,难度不大,注意根据燃烧通式判断耗氧量问题,注意对规律的归纳总结.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
19.下列装置、操作及说法正确的是( )
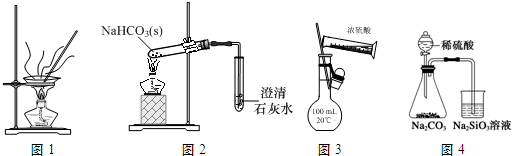

| A. | 用图1装置灼烧CuSO4•5H2O晶体除去结晶水 | |
| B. | 用图2装置探究NaHCO3的热稳定性 | |
| C. | 用图3装置配制100 mL 0.1 mol•L-1的硫酸 | |
| D. | 用图4装置比较硫、碳、硅三种元素的非金属性强弱 |
20.NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 0.1molFe在0.1mol氯气中充分燃烧时转移的电子数为0.3NA | |
| B. | 0.1mol乙烷和丙烯的混合物所含氢原子数目为0.6NA | |
| C. | 64g的SO2与足量的O2充分反应后可得到NA个S03分子 | |
| D. | 标准状况下,2.24L HF含有的分子数目为0.1NA |
17.下列关于化学键的叙述中正确的是( )
| A. | 化学键存在于原子之间,也存在于分子之间 | |
| B. | 两个原子之间的相互作用叫做化学键 | |
| C. | 离子键是阴、阳离子之间的相互吸引力 | |
| D. | 化学键通常是指相邻的两个或多个原子之间强烈的相互作用 |
 二氧化硫常用作消毒剂和漂白剂,也是一种重要的工业原料.
二氧化硫常用作消毒剂和漂白剂,也是一种重要的工业原料.
 .
. .
. .
.