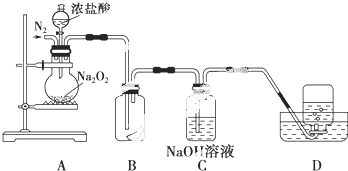
题目内容
16.下列各组物质的性质比较中,正确的是( )| A. | 热稳定性:Na2CO3>NaHCO3>H2CO3 | B. | 溶解度:Na2CO3<NaHCO3 | ||
| C. | 熔点:Rb>K>Na>Li | D. | 还原性:Rb<K<Na<Li |
分析 A、NaHCO3与Na2CO3相比较,NaHCO3不稳定,加热易分解;
B、常温时,NaHCO3与Na2CO3相比较,Na2CO3溶解度较大;
C、碱金属单质的熔点随着原子序数的递增而逐渐升高;
D、碱金属单质的还原性随着原子序数的递增而逐渐增强.
解答 解:A、NaHCO3与Na2CO3相比较,NaHCO3不稳定,加热易分解,碳酸易分解,稳定性小于碳酸氢钠,即热稳定性:Na2CO3>NaHCO3>H2CO3,故A正确;
B、常温时,NaHCO3与Na2CO3相比较,Na2CO3溶解度较大,溶解度:Na2CO3>NaHCO3,故B错误;
C、碱金属单质的熔点随着原子序数的递增而逐渐升高,即熔点:Rb<K<Na<Li,故C错误;
D、碱金属单质的还原性随着原子序数的递增而逐渐增强还原性:Rb>K>Na>Li,故D错误.
故选A.
点评 本题考查学生元素周期律的应用知识,注意知识的迁移和应用是关键,难度中等.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
7.下列各组离子在指定溶液中,一定能大量共存的是( )
| A. | 加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl-,SO42- | |
| B. | 含有NaClO的溶液中:K+,Al3+,Br-,S2- | |
| C. | 澄清透明溶液:Cu2+、SO42-、HCO3-、H+ | |
| D. | 使甲基橙变红的溶液中:Fe2+,MnO4-,Na+,SO42- |
4.下列表示对应化学反应的离子方程式正确的是( )
| A. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | |
| C. | 向FeBr2溶液中通入足量 Cl2:2Fe2++2Br-+2Cl2═Br2+2Fe3++4Cl- | |
| D. | 向50 mL 1 mol•L-1明矾溶液中滴入两滴0.1 mol•L-1Ba(OH)2溶液:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
11.下列有关叙述正确的是( )
| A. | HClO的电子式为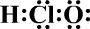 | |
| B. | 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 | |
| C. | CH3COOH溶液和NaCl溶液均通过离子导电,说明CH3COOH和NaCl中均含离子键 | |
| D. | Cl2、SO2均能使品红溶液褪色,说明二者均有较强的氧化性 |
8.可能存在的第119号未知元素,有人称为“类钫”,它位于碱金属族,根据周期表结构及元素性质变化趋势,下列关于碱金属某些元素原子的结构和性质的判断,错误的是( )
①锂与水反应比钠剧烈 ②碱金属单质都需要密封保存在煤油中 ③锂的氧化物暴露在空气中易吸收二氧化碳 ④锂的阳离子的最外层电子数和钠的相同 ⑤“类钫”单质是强还原剂 ⑥“类钫”在化合物中是+1价⑦“类钫”单质的密度大于l g•cm-3⑧“类钫”单质有较高的熔点.
①锂与水反应比钠剧烈 ②碱金属单质都需要密封保存在煤油中 ③锂的氧化物暴露在空气中易吸收二氧化碳 ④锂的阳离子的最外层电子数和钠的相同 ⑤“类钫”单质是强还原剂 ⑥“类钫”在化合物中是+1价⑦“类钫”单质的密度大于l g•cm-3⑧“类钫”单质有较高的熔点.
| A. | ①②④⑧ | B. | ①②③⑦ | C. | ③④⑤⑧ | D. | ①③④⑦ |
6.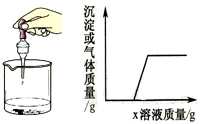 向烧杯中逐滴加入x溶液至过量,反应过程中生成沉淀或气体的质量与加入x溶液的质量关系能用如图所示的曲线表示的是( )
向烧杯中逐滴加入x溶液至过量,反应过程中生成沉淀或气体的质量与加入x溶液的质量关系能用如图所示的曲线表示的是( )
 向烧杯中逐滴加入x溶液至过量,反应过程中生成沉淀或气体的质量与加入x溶液的质量关系能用如图所示的曲线表示的是( )
向烧杯中逐滴加入x溶液至过量,反应过程中生成沉淀或气体的质量与加入x溶液的质量关系能用如图所示的曲线表示的是( )| 序号 | 烧杯中的物质 | x溶液 |
| A | 生锈的铁钉 | 稀HCl |
| B | 盐酸与稀硫酸 | BaCl2溶液 |
| C | 镁铝合金 | NaOH溶液 |
| D | AlCl3和MgCl2溶液 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |