题目内容
【题目】元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p 轨道上有4个电子.元素Z 的原子最外层电子数是其内层的3倍.
(1)X与Y所形成化合物晶体的晶胞如图所示.在1个晶胞中,X离子的数目为 .
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是 .
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是 .
(4)Y与Z可形成YZ42﹣ , YZ42﹣的空间构型为(用文字描述);写出一种与YZ42﹣互为等电子体的分子的化学式: . 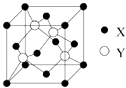
【答案】
(1)4
(2)sp3杂化
(3)水分子与乙醇分子之间形成氢键
(4)正四面体;CCl4或SiCl4
【解析】解:元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,核外电子数为2+8+18+2=30,则X为Zn;元素Y基态原子的3p轨道上有4个电子,则Y为S元素;元素Z的原子最外层电子数是其内层的3倍,原子只能有2个电子层,最外层电子数为6,故Z为O元素.(1)在一个晶胞中,X离子的数目8× ![]() +6×
+6× ![]() =4,所以答案是:4;(2)H2S分子中S原子杂化轨道数目为2+
=4,所以答案是:4;(2)H2S分子中S原子杂化轨道数目为2+ ![]() =4,S原子采取sp3杂化,所以答案是:sp3杂化;(3)水分子与乙醇分子之间形成氢键,H2O在乙醇中的溶解度大于H2S,所以答案是:水分子与乙醇分子之间形成氢键;(4)SO42﹣中S原子孤电子对数为
=4,S原子采取sp3杂化,所以答案是:sp3杂化;(3)水分子与乙醇分子之间形成氢键,H2O在乙醇中的溶解度大于H2S,所以答案是:水分子与乙醇分子之间形成氢键;(4)SO42﹣中S原子孤电子对数为 ![]() =0,价层电子对数为4+0=4,故其空间结构为正四面体,一种与SO42﹣互为等电子体的分子的化学式:CCl4或SiCl4 , 所以答案是:正四面体;CCl4或SiCl4 .
=0,价层电子对数为4+0=4,故其空间结构为正四面体,一种与SO42﹣互为等电子体的分子的化学式:CCl4或SiCl4 , 所以答案是:正四面体;CCl4或SiCl4 .

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目






