��Ŀ����
X��Y��Z��ԭ���������ε����Ķ�����Ԫ�أ�3��Ԫ�ص�ԭ�Ӻ��������֮����Ca2���ĺ����������ȣ�X��Z�ֱ�õ�һ�����Ӻ���γ�ϡ������ԭ�ӵ��ȶ����Ӳ�ṹ������˵����ȷ����
A��ԭ�Ӱ뾶��Z��Y��X
B��Z��X�γɻ�����ķе����Z��ͬ��Ԫ����X�γɻ�����ķе�
C��CaY2��ˮ����������ԭ��Ӧʱ��CaY2ֻ��������
D��CaX2��CaY2��CaZ2��3�ֻ������У��������������Ӹ����Ⱦ�Ϊ1�U2
B
��������Ca2+�ĺ��������Ϊ18��X���ڷֱ�õ�һ�����Ӻ���γ�ϡ������ԭ�ӵ��ȶ����Ӳ�ṹ˵��X��Z���γɸ�1�����ӣ���XΪH��ZΪF����X������ΪF��Z������ΪCl���ɴ˿ɽ�һ���Ƴ�YΪO��ԭ�Ӱ뾶��O>F>H��A�����HF���Ӽ�������������е���ͬ����Ԫ���⻯������ߵģ�B����ȷ��CaO2��ˮ������Ӧʱ��O22���绯��������������������ԭ����C�����CaO2�е��������������Ӹ����Ⱦ�Ϊ1:1��D�����
�����㶨λ�����⿼�������Ԫ�ص������ƶϺ�Ԫ�����ڱ�֪ʶ��

 ������ѧ���̲���ȫ���ϵ�д�
������ѧ���̲���ȫ���ϵ�д� ������ʱ����ҵ����ϵ�д�
������ʱ����ҵ����ϵ�д�[14��]��֪��I2��2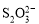

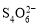 ��2I�D��������ʵ��ܶȻ��������±���
��2I�D��������ʵ��ܶȻ��������±���
���� | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2��10��20 | 2.6��10��39 | 1.7��10��7 | 1.3��10��12 |
��1��ij����CuCl2��Һ�к���������FeCl3��Ϊ�õ�������CuCl2?2H2O���壬���� ����pH��4��ʹ��Һ�е�Fe3��ת��ΪFe(OH)3��������ʱ��Һ�е�c(Fe3��)��____________________��
���˺�������Һ����������Ũ���ᾧ���ɵõ�CuCl2?2H2O���塣
��2���ڿ�����ֱ�Ӽ���CuCl2?2H2O����ò���������ˮCuCl2��ԭ����_______________�����û�ѧ����ʽ��ʾ������CuCl2?2H2O����õ�������ˮCuCl2�ĺ���������_______��
��3��ijѧϰС���á���ӵ��������ⶨ����CuCl2?2H2O�������������������I�D������Ӧ�������������ʣ��Ĵ��ȣ��������£�ȡ0.36 g��������ˮ���������KI���壬��ַ�Ӧ�����ɰ�ɫ��������0.1000 mol/L Na2S2O3����Һ�ζ�������ζ��յ�ʱ������Na2S2O3����Һ20.00 mL��
����ѡ��___________���ζ�ָʾ�����ζ��յ��������_________________��
��CuCl2��Һ��KI��Ӧ�����ӷ���ʽΪ______________________________��
����������CuCl2?2H2O�������ٷ���Ϊ___________________________��






