题目内容
已知镓和铝在周期表中位于同一纵行,氮化镓可把手机信号扩大10倍,让电脑的速度提高1万倍,将CD缩减到1英寸……,下列有关氮化镓的说法中正确的是 ( )
A.氮化镓是由主族元素与副族元素形成的化合物 B.氮化镓能把白铁变成黄金
C.氮化镓中氮元素显+3价 D.氮原子最外层比镓原子最外层多2个电子
D
【解析】
试题分析:A.N、Ga都是主族元素,因此氮化镓完全是由主族元素形成的化合物。错误。B.根据题意元素形成新的物质,会使物质增值很多,但是也要化学反应的过程就是原子重新组合的过程。所以从化学角度看白铁不可能变成黄金。错误。C.在化合物中正负化合价的代数和为0.由于非金属性N>Ga.所以在氮化镓中氮元素显-3价。错误。D.氮原子最外层有5个电子,而镓原子最外层有3个电子,因此N比Ga最外层多2个电子。正确。
考点:考查元素在周期表中的物质及与结构、性质的关系的知识。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案(12分)甲同学拟通过实验探究同主族元素性质的递变规律,以及影响化学反应速率的因素。其设计的实验方案如下,请你帮他填写完整,并做出评价。
实验室提供的试剂:锌块、锌粉、铁条、铁粉、铜条、NaBr溶液、NaI溶液、新制的氯水、1mol/L盐酸、3mol/L的盐酸
(1)探究同主族元素性质的递变规律
①写出下列实验报告中的实验现象和离子方程式
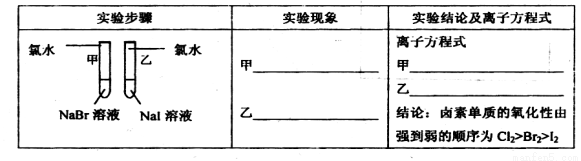
②【评价】甲同学设计的实验方案的合理性是___________(填序号)
A. 非常合理B. 部分合理C. 完全不合理
③【补充和完善】上一题②中若选A,则此项不用再作答,若选B或C,则完成实验还需要的试剂是___________。
(2)探究影响化学反应速率的因素
实验步骤 | 实验现象 | 实验依据和结论 |
3mL1mol/L 3mL3mol/L 盐酸 盐酸 (金属质量相同,盐酸均过量) | 均有气体生成,锌粉先消失,锌块后消失 | 因为乙试管中的反应更快,所以反应物浓度越大,反应速率越快。 |
甲同学所得实验依据和结论有明显问题,问题是 。
(3)请你利用原电池原理,设计实验,比较铜和铁的金属活动性。画出实验装置图,标出正负极、电子流动方向,写出电极反应式。




