题目内容
【题目】室温下,在1L 0.1mol·L-1NH4Cl溶液中,
(1)水解的离子反应方程式________
(2)溶液中存在的微粒种类:H2O、________
(3)溶液中各种离子浓度从大到小的顺序为:________
(4)溶液中存在的电荷守恒等式 ________
(5)溶液中存在的物料守恒等式 ________
【答案】NH4++H2O![]() NH3H2O+H+ NH4+、NH3H2O 、OH-、Cl-、H+ c(Cl-)>c(NH4+)>c(H+)>c(OH-) c(NH4+)+c(H+)=c(OH-)+c(Cl-) c(NH4+)+c(NH3H2O)=c(Cl-)
NH3H2O+H+ NH4+、NH3H2O 、OH-、Cl-、H+ c(Cl-)>c(NH4+)>c(H+)>c(OH-) c(NH4+)+c(H+)=c(OH-)+c(Cl-) c(NH4+)+c(NH3H2O)=c(Cl-)
【解析】
(1)氯化铵为强酸弱碱盐,铵根离子水解,方程式为NH4++H2O![]() NH3H2O+H+;
NH3H2O+H+;
(2)溶液中存在水的电离平衡、铵根离子的水解平衡,故微粒种类除水之外有NH4+、NH3H2O 、OH-、Cl-、H+;
(3)由于铵根离子水解,故其浓度小于氯离子浓度,由于溶液显酸性,则氢离子浓度大于氢氧根离子,溶液中各种离子浓度从大到小的顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(4)溶液中存在的电荷守恒等式c(NH4+)+c(H+)=c(OH-)+c(Cl-);
(5)若铵根离子不水解,则c(NH4+)=c(Cl-),但因为存在水解反应,则N的存在形式为铵根离子和一水合氨,故c(NH4+)+c(NH3H2O)=c(Cl-)。

【题目】如表是几种常见弱酸的电离平衡常数(25℃)。
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 1.76×10-5 |
H2CO3 | H2CO3 | K1=4.4×10-7 |
HCO | K2=4.7×10-11 | |
H2S | H2S | K1=1.3×10-7 |
HS- | K2=7.1×10-15 | |
H3PO4 | H3PO4 | K1=7.1×10-3 |
H2PO4- | K2=6.3×10-8 | |
HPO42- | K3=4.2×10-13 |
(1) 当温度升高时,K值_____(填“增大”“减小”或“不变”)。
(2) 若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看成酸,其中酸性最强的是_____,最弱的是_____。由离子反应规律及上述数据判断,下列各组物质在溶液中混合后能发生反应的有_____(填字母)。
a. CH3COOH+NaH2PO4
b. H2S+Na2CO3
c. CO2+Na2HPO4
(3) 分析多元弱酸各步电离的K值大小,你认为一定浓度的某多元弱酸溶液中,c(H+)的大小主要由_______决定。假设某氢硫酸溶液的浓度为0.001 3 mol·L-1,则溶液中c(H+)=______。
(4) 请设计一种方案,能通过直观的实验现象判断醋酸的酸性强于碳酸,该方案所用试剂是____,反应的化学方程式为_____。
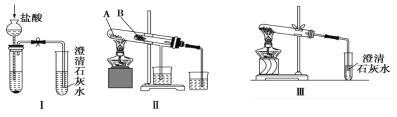
【题目】下列设计的实验方案能达到相应实验目的的是( )
选项 | 实验目的 | 实验方案 |
A | 探究化学反应的限度 | 取5mL 0.1mol/L KI溶液,滴加0.1mol/L FeCl3溶液5~6滴,充分反应,可根据溶液中既含I2又含I-的实验事实判断该反应是可逆反应 |
B | 探究浓度对化学反应速率的影响 | 用两支试管各取5mL 0.1mol/L的KMnO4溶液,分别加入2mL 0.1mol/L和 0.2mol/L的H2C2O4(草酸 |
C | 证明乙醇的消去反应有乙烯生成 | 将含有浓硫酸的乙醇溶液迅速升温至170℃,将产生的气体直接通入酸性KMnO4溶液中 |
D | 验证醋酸钠溶液中存在水解平衡 | 取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体 |
A.AB.BC.CD.D