题目内容
已知:①A、B、C、D四种物质均含元素X,有的还可能含有元素Y、Z。元素Y、X、Z的原子序数依次递增。
②X在A、B、C、D中都不呈现它的最高化合价。
③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。
④化合物D受热催化分解,可制得元素Y的单质。
(1)元素X是_________,Z是_________.
(2)写出③中反应的化学方程式
________________________________________________________.
(3)写出④中反应的化学方程式
_________________________________________________________.
答案:
解析:
提示:
解析:
| (1)Cl(或氯) K(或钾)
(2) (3)
|
提示:
| 已知条件③可以作为解决本题的突破口。常见的一元强碱,应该考虑为KOH和NaOH。和碱作用的单质A,可以从金属单质和非金属单质两个方面去分析。金属单质与碱反应,则是两性的金属,如Zn、Al等。产物中经常是得到AlO 如何判断是KOH还是NaOH呢?如何判断是Cl2,是B2还是I2呢?从条件①中给出的原子序数将会起决定性作用。但在此之前,还必须判断出一元强碱中的金属元素是Y还是Z。④中的含卤素的化合物D受热分解会制得元素Y的单质,这种单质显然不会是金属钠或金属钾。金属钠和钾的制取绝不会用热分解含卤化合物的方法。故碱中的金属元素是Z。 若元素X是Br,则金属元素是钾或钠均不合题意,因其原子序数都小于Br。故元素X是氯,于是可以同时确定金属元素Z是钾。 由条件④中制单质Y的反应,以催化分解KClO3为最典型。Y应是氧元素。因此Y、X、Z应分别是O、Cl、K。 由条件③的歧化反应产物之一是B或C中含有氧元素,D中亦含有氧元素,因此Y为氧元素是最合理的。不然,通过加热含氯的化合物来制备的单质又会是什么呢?D又不是高氯酸钾,因为题设D中X不显最高化合价。
|

练习册系列答案
相关题目
H2和I2在一定条件下能发生反应:H2(g)+I2(g)?2HI(g)△H=-a kJ?mol-1
已知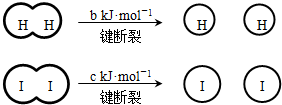 (a、b、c均大于零)
(a、b、c均大于零)
下列说法不正确的是( )
已知
 (a、b、c均大于零)
(a、b、c均大于零)下列说法不正确的是( )
| A、反应物的总能量高于生成物的总能量 | B、断开1mol H-H键和1mol I-I键所需能量大于断开2mol H-I键所需能量 | C、断开2mol H-I键所需能量约为(c+b+a)kJ | D、向密闭容器中加入2mol H2和2mol I2,充分反应后放出的热量小于2a kJ |

 已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大.A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.
已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大.A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.
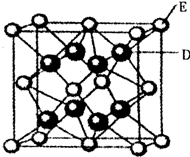 已知:A、B、C、D、E、F是周期表中前36号元素,A是原子半径最小的元素,B元素基态原子的2P轨道上只有两个电子,C元素的基态原子L层只有2对成对电子,D是元素周期表中电负性最大的元素,E2+的核外电子排布和Ar原子相同,F的核电荷数是D和E的核电荷数之和.
已知:A、B、C、D、E、F是周期表中前36号元素,A是原子半径最小的元素,B元素基态原子的2P轨道上只有两个电子,C元素的基态原子L层只有2对成对电子,D是元素周期表中电负性最大的元素,E2+的核外电子排布和Ar原子相同,F的核电荷数是D和E的核电荷数之和.