题目内容
14.将10mL质量分数为48%的H2SO4溶液,用水稀释至100mL,所得H2SO4溶液的质量分数>4.8%(选填“>”、“<”或“=”).分析 设质量分数为48%的H2SO4溶液的密度为ρ,则10mL浓硫酸的质量为10ρg,用水稀释至100mL,此时的密度设为ρ′,硫酸的浓度越小密度越小,结合质量分数的计算公式分析.
解答 解:设质量分数为48%的H2SO4溶液的密度为ρ,则10mL浓硫酸的质量为10ρg,用水稀释至100mL,此时的密度设为ρ′,则其质量为100ρ′g,硫酸的浓度越小密度越小,稀释后H2SO4的质量分数约为 $\frac{10ρ×48%}{100ρ′}$×100%=$\frac{ρ}{ρ′}$×4.8%,由于ρ>ρ′,所以=$\frac{ρ}{ρ′}$×4.8%>4.8%;
故答案为:>.
点评 本题考查溶液浓度有关计算,比较基础,关键是明确硫酸的浓度越大密度越大,注意对公式的理解与灵活应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列各组离子一定能大量共存的是( )
| A. | 在pH=1的溶液中:Na+、NO3-、I-、K+ | |
| B. | 常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl- | |
| C. | 常温下水电离的c(OH-)=1×10-13mol•L-1的溶液中:NH4+、HCO3-、SO42-、Cl- | |
| D. | 含有HCO3-的溶液中:K+、NH4+、NO3-、Ca2+ |
2.下列根据实验现象所得出的结论中,一定正确的是( )
| 选项 | 实验现象 | 结论 |
| A | 无色试液中加入AgNO3溶液产生白色沉淀 | 试液中含有Cl- |
| B | 无色溶液加酚酞变红色 | 溶液的溶质是碱 |
| C | 碱性无色溶液中加入Na2CO3溶液产生白色沉淀 | 溶液中有Ca(OH)2 |
| D | 某气体能使湿润的红色石蕊试纸变蓝色 | 该气体中有NH3 |
| A. | A | B. | B | C. | C | D. | D |
9.火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2═Cu2S+2FeS+SO2.下列说法正确的是( )
| A. | CuFeS2仅作还原剂,硫元素被氧化 | |
| B. | 每生成1molSO2,反应共转移6mol电子 | |
| C. | CuFeS2中被氧化的原子和被还原的原子数目之比为2:1 | |
| D. | 该反应中有两种物质作还原剂 |
19.下列说法不正确的是( )
| A. | 乙烯、乙醇均能使酸性高锰酸钾溶液褪色 | |
| B. | 通过乙烷的取代反应或乙烯的加成反应都可以制取纯净的氯乙烷 | |
| C. | 乙烯、环己烷都属于烃类,它们通式相同,但它们不互为同系物 | |
| D. | 烯烃完全燃烧时,生成CO2和H2O的物质的量相等 |
6.在某无色透明的碱性溶液中,能大量共存的离子组是( )
| A. | Na+、K+、SO42-、HCO3- | B. | Ba2+、K+、Cl-、NO3- | ||
| C. | Cu2+、K+、Cl-、NO3- | D. | Fe3+、K+、SO42-、Cl- |
3.下列各组物质,互为同系物的是( )
| A. | CH3-CH=CH2与  | B. |  与 与 | ||
| C. | 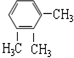 与 与 | D. | CH3CH2Cl 与CH3CHCl-CH2Cl |
 核电荷数由小到大顺序排列的五种短周期元素X、Y、Z、W、Q.其中:在同周期中,Z的金属性最强,Q的非金属性最强; W的单质是淡黄色固体; X、Y、W在周期表中的相对位置关系如图所示:
核电荷数由小到大顺序排列的五种短周期元素X、Y、Z、W、Q.其中:在同周期中,Z的金属性最强,Q的非金属性最强; W的单质是淡黄色固体; X、Y、W在周期表中的相对位置关系如图所示: