题目内容
【题目】T℃时,向2.0L恒容密闭容器中充入0.80molA,发生反应:![]()
![]() ,经一段时间后达到平衡。反应过程中测定的部分数据见表:
,经一段时间后达到平衡。反应过程中测定的部分数据见表:
时间/min | 0 | 10 | 20 | 30 | 40 |
| 0.80 | 0.60 | 0.48 |
|
|
| 0.00 | 0.20 |
| 0.40 | 0.40 |
下列说法不正确的是
A.该反应在30min时已达到平衡
B.反应在前20min的平均速率为![]()
C.保持其他条件不变,升高温度,平衡时,![]() ,则
,则![]()
D.相同温度下,起始时向容器中充入0.10molA、0.10molB和0.30molC,达到平衡前的反应速率:v逆>v正
【答案】D
【解析】
前30min,B的物质的量增大了0.40mol,30min之后,B的物质的量不再增大,说明该反应在30min时已达到平衡。因为A和B的计量数都为1,A的物质的量减小量=B的物质的量增大量=0.40mol,所以n2=n3=0.80mol-0.40mol=0.40mol,据此解答。
A.30min之后,B的物质的量不再改变,说明该反应在30min时已达到平衡,A正确;
B.反应在前20min的平均速率![]() ,所以v(C)=v(A)=
,所以v(C)=v(A)=![]() ,B正确;
,B正确;
C.由分析可知,T℃时达到平衡,c(A)=![]() ,保持其他条件不变,升高温度,平衡时,
,保持其他条件不变,升高温度,平衡时,![]() <0.2
<0.2![]() ,说明升高温度,平衡正向移动,该反应的正反应为吸热反应,
,说明升高温度,平衡正向移动,该反应的正反应为吸热反应,![]() >0,即
>0,即![]() ,C正确;
,C正确;
D.T℃平衡时,c(B)=c(C)=![]() ,c(A)=
,c(A)=![]() 该反应的平衡常数K=
该反应的平衡常数K=![]() =0.2mol/L,相同温度下,起始时向容器中充入0.10molA、0.10molB和0.30molC,QC=
=0.2mol/L,相同温度下,起始时向容器中充入0.10molA、0.10molB和0.30molC,QC=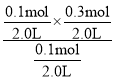 =0.15mol/L,QC<K,平衡正向进行,v逆<v正,D错误。
=0.15mol/L,QC<K,平衡正向进行,v逆<v正,D错误。
答案选D。

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目