题目内容
【题目】已知:某废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关图像如下所示:
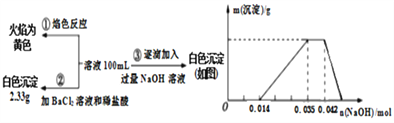
请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的阴离子是______________,一定存在的阳离子是______________________。
(2)写出实验③图像中沉淀达到最大量且质量不再发生变化阶段发生反应的离子反应方程式:_____________________________________________。
(3)分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为________,所得沉淀的最大质量是____g。
(4)若通过实验确定原废水中c(Na+)=0.14 mol·L-1,c(NO3-)=____________ mol·L-1。
【答案】 CO32- Na+、H+、Al3+、NH4+ NH4+ + OH﹣ = NH3·H2O 1:1 0.546 0.36
【解析】焰色反应为黄色,说明含有钠离子;加入盐酸酸化的氯化钡溶液产生2.33g白色沉淀是硫酸钡,物质的量是0.01mol,因此含有SO42-离子,且物质的量是0.01mol;逐滴加入氢氧化钠溶液开始阶段没有沉淀产生,说明一定存在氢离子,所以不存在CO32-,该阶段消耗氢氧化钠是0.014mol,所以氢离子是0.014mol,沉淀达到最大值以后沉淀不变化,说明该阶段是铵根与氢氧根反应,即一定存在铵根,该阶段消耗氢氧根是0.042mol-0.035mol=0.007mol,因此铵根是0.007mol;最后沉淀完全消失,说明一定不存在Fe3+、Mg2+。生成氢氧化铝消耗氢氧化钠是0.035mol-0.014mol=0.021mol,所以Al3+是0.007mol。由于阳离子所带正电荷数大于硫酸根离子所带负电荷数,因此还一定存在硝酸根离子。
(1)根据以上分析可知废水中一定不存在的阴离子是CO32-,一定存在的阳离子是Na+、H+、Al3+、NH4+。(2)实验③图像中沉淀达到最大量且质量不再发生变化阶段发生反应的离子反应方程式为NH4++OH﹣=NH3·H2O。(3)根据以上分析可知在原溶液中c(NH4+)与c(Al3+)的比值为1:1,所得沉淀的最大质量是0.007mol×78g/mol=0.546g。(4)若通过实验确定原废水中c(Na+)=0.14 mol·L-1,则根据电荷守恒可知c(NO3-)=(0.14+0.07+0.07×3+0.14-0.1×2)mol/L=0.36mol·L-1。

【题目】PCl5(g)一定条件下可以转化成PCl3(g)或红磷P(s).
(1)已知: PCl5(g)═PCl3(g)+Cl2(g)△H1K1
PCl3(g)═P(s)+ ![]() Cl2(g)△H2K2
Cl2(g)△H2K2
K1、K2表示该反应的平衡常数.
则PCl5(g)═P(s)+ ![]() Cl2(g)该反应的△H=(用△H1、△H2表示),反应的平衡常数K=(用K1、K2表示).
Cl2(g)该反应的△H=(用△H1、△H2表示),反应的平衡常数K=(用K1、K2表示).
(2)在210℃时,将4mol PCl3气体充入1L真空恒容密闭容器中发生反应:2PCl3(g)═2P(s)+3Cl2(g) 测得数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(PCl3)/mol | 4 | 2.8 | 2 | 1 | 1 |
并测得反应达到平衡时热量变化数值为Q,反应平衡常数为K,PCl3转化率为α.
①0~30min时,用Cl2表示该反应的反应速率为;平衡时,PCl3转化率α=;该温度下反应的平衡常数K= .
②其它条件保持不变,若上述反应在恒压条件下进行反应,达平衡时测得热量变化数值、平衡常数、PCl3转化率分别为Q′、K′、α′,则Q′(填“>”“<”或“=”,下同)Q,K′K,α′α.
③保持其它条件不变,若向上述平衡体系中再充入1molCl2(g)、1molP(s)和1molPCl3(g),则上述平衡反应(填“正向”、“逆向”或“不”)移动.

