题目内容
以下是FeSO4?7H2O的实验室制备流程图.根据题意完成下列填空:

(1)碳酸钠溶液能除去酯类油污,是因为______(用离子方程式表示),反应Ⅰ需要加热数分钟,其原因是______.
(2)废铁屑中含氧化铁,无需在制备前除去,理由是(用离子方程式回答)______,______.
(3)判断反应Ⅱ完成的现象是:______.
以下是测定某补血剂(FeSO4?7H2O)中铁元素含量的流程图.根据题意完成下列填空:

(4)步骤Ⅲ需要100mL1mol/L的稀硫酸,用98.3%,ρ=1.84g/cm3的浓硫酸配制,所用的仪器有量筒、烧杯、玻璃棒、胶头滴管及______.
(5)步骤Ⅴ一系列操作依次是:①过滤②洗涤③______④冷却⑤称量⑥恒重操作.
(6)假设实验无损耗,则每片补血剂含铁元素的质量______g(用含a的代数式表示).
解:((1)CO32-水解生成OH-,酯在碱性条件下完全水解,所以可用纯碱溶液除油污.升温,促进水解,溶液碱性增强,使反应充分进行.
故答案为:CO32-+H2O HCO3-+OH-;升温,促进水解,溶液碱性增强,使反应充分进行.
HCO3-+OH-;升温,促进水解,溶液碱性增强,使反应充分进行.
(2)废铁中含氧化铁,无需制备前除去,因最终溶液是FeSO4溶液,氧化铁和硫酸生成硫酸铁、铁和硫酸铁生成硫酸亚铁,
离子方程式为:Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+.
(3)铁与硫酸反应基本完成的现象是溶液中不再有气泡产生、铁粉不再溶解.故答案为:铁粉不再溶解,铁粉表面不再有气泡产生
(4)用98.3%,ρ=1.84g/cm3的浓硫酸配制100mL1mol/L的稀硫酸需还需要的仪器是100mL容量瓶.故答案为:100mL容量瓶
(5)步骤V最终得到氧化铁固体,所以其过程为过滤、洗涤、灼烧、冷却、称量、恒重.故答案为:灼烧;
(6)agFe2O3中Fe元素质量为:ag× =0.7ag,由铁元素守恒,1片补血剂中铁元素质量为0.07ag.故答案为:0.07a.
=0.7ag,由铁元素守恒,1片补血剂中铁元素质量为0.07ag.故答案为:0.07a.
分析:(1)考虑CO32-水解及温度对水解的影响;
(2)废铁中含氧化铁,因最终溶液是FeSO4溶液,氧化铁和硫酸生成硫酸铁、铁和硫酸铁生成硫酸亚铁;
(3)分析铁与硫酸反应的现象;
(4)配制一定物质的量浓度的溶液一定要用到容量瓶;
(5)步骤V最终得到氧化铁固体,所以其过程为过滤、洗涤、灼烧、冷却、称量、恒重.
(6)agFe2O3中Fe元素质量为0.7ag,由铁元素守恒,1片补血剂中铁元素质量为0.07ag.
点评:本题属于工艺流程图类题目.此类题目一般起点高,但落点低,一定要按题中要求准确表达(文字、化学用语).
故答案为:CO32-+H2O
 HCO3-+OH-;升温,促进水解,溶液碱性增强,使反应充分进行.
HCO3-+OH-;升温,促进水解,溶液碱性增强,使反应充分进行.(2)废铁中含氧化铁,无需制备前除去,因最终溶液是FeSO4溶液,氧化铁和硫酸生成硫酸铁、铁和硫酸铁生成硫酸亚铁,
离子方程式为:Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+.
(3)铁与硫酸反应基本完成的现象是溶液中不再有气泡产生、铁粉不再溶解.故答案为:铁粉不再溶解,铁粉表面不再有气泡产生
(4)用98.3%,ρ=1.84g/cm3的浓硫酸配制100mL1mol/L的稀硫酸需还需要的仪器是100mL容量瓶.故答案为:100mL容量瓶
(5)步骤V最终得到氧化铁固体,所以其过程为过滤、洗涤、灼烧、冷却、称量、恒重.故答案为:灼烧;
(6)agFe2O3中Fe元素质量为:ag×
 =0.7ag,由铁元素守恒,1片补血剂中铁元素质量为0.07ag.故答案为:0.07a.
=0.7ag,由铁元素守恒,1片补血剂中铁元素质量为0.07ag.故答案为:0.07a.分析:(1)考虑CO32-水解及温度对水解的影响;
(2)废铁中含氧化铁,因最终溶液是FeSO4溶液,氧化铁和硫酸生成硫酸铁、铁和硫酸铁生成硫酸亚铁;
(3)分析铁与硫酸反应的现象;
(4)配制一定物质的量浓度的溶液一定要用到容量瓶;
(5)步骤V最终得到氧化铁固体,所以其过程为过滤、洗涤、灼烧、冷却、称量、恒重.
(6)agFe2O3中Fe元素质量为0.7ag,由铁元素守恒,1片补血剂中铁元素质量为0.07ag.
点评:本题属于工艺流程图类题目.此类题目一般起点高,但落点低,一定要按题中要求准确表达(文字、化学用语).

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目

 HCO3-+OH-
HCO3-+OH-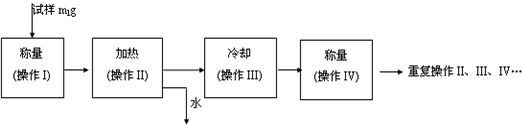


 中铁屑过量的目的是(用离子方程式表示): ▲ 。步骤2中溶液趁热过滤的原因是 ▲ 。
中铁屑过量的目的是(用离子方程式表示): ▲ 。步骤2中溶液趁热过滤的原因是 ▲ 。 加热到 ▲ 时,停止加热。需经过的实验操作包括: ▲ 、 ▲ 、减压过滤(或抽滤)等得到较为 ▲ 的晶体。
加热到 ▲ 时,停止加热。需经过的实验操作包括: ▲ 、 ▲ 、减压过滤(或抽滤)等得到较为 ▲ 的晶体。 量,一般采用在酸性下用KMnO4标准液滴定的方法。
量,一般采用在酸性下用KMnO4标准液滴定的方法。 (7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为: ▲ 。(用a,b,c回答)
(7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为: ▲ 。(用a,b,c回答)