题目内容
工业甲醇的质量分数可以用下列方法测定:
①在稀H2SO4中甲醇被Cr2O72-氧化成CO2和H2O,反应式为:CH3OH+Cr2O72-+8H+=CO2↑+2Cr3++6H2O;
②过量的Cr2O72-可用Fe2+与之完全反应:
______Cr2O72-+______Fe2++______H+-______Cr3++______Fe3++______H2O
现有0.12g工业甲醇,在H2SO4溶液中与25mL 0.2mol?L-1K2Cr2O7溶液反应,多余的K2Cr2O7再用1mol?L-1FeSO4与其反应,结果用去FeSO4溶液9.6mL.
(1)配平第②步中离子方程式.
(2)计算工业甲醇的质量分数.
(2)由反应②可知,反应①剩余的n(Cr2O72-)=
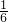 n(Fe2+)=0.0016 mol
n(Fe2+)=0.0016 mol 反应①消耗的n(Cr2O72-)=0.0050 mol-0.0016 mol=0.0034 mol
则:n(CH3OH)=0.0034 mol
w(CH3OH)=
 ×100%=90.7%
×100%=90.7% 故答案为:90.7%
分析:(1)依据化学反应的元素化合价变化结合电子守恒、电荷守恒、原子守恒计算配平离子方程式;
(2)依据化学方程式的定量计算分析,依据FeSO4的消耗量,计算出多余的K2Cr2O7,计算与甲醇反应的K2Cr2O;结合化学方程式进行计算:CH3OH+Cr2O72-+8H+=CO2↑+2Cr3++6H2O;
点评:本题考查了氧化还原反应的离子方程式的配平方法,主要是电子守恒、电荷守恒、原子守恒的应用,化学方程式的综合计算方法应用.

 阅读快车系列答案
阅读快车系列答案
| |||||||||||
| |||||||||||