题目内容
将2.525gKNO3固体,加到0.93mol×L-1 FeSO4溶液100mL中,滴入稀H2SO4酸化,充分反应后,剩余的Fe2+恰好与201.6mL标况下的Cl2完全反应。根据以上实验数据回答:(1)推断还原产物中氮元素的化合价。
(2)KNO3在上述酸性溶液中发生反应的化学方程式。
(3)若将25.854g硫酸亚铁的结晶水合物溶于水冲稀到100mL,就是上述使用的0.93mol×L-1的溶液,则结晶水合物的化学式。
(4)简述为什么要用稀H2SO4酸化?
答案:
解析:
解析:
| 本题中的氧化剂为KNO3、Cl2,还原剂为FeSO4,根据氧化还原反应中电子得失守恒,设KNO3中+5价氮被还原为x价,则:
x=2 解:(1)N的化合价为+2价 (2)2KNO3+6FeSO4+4H2SO4═K2SO4+3Fe2(SO4)3+2NO↑+4H2O (3)假设该结晶水合物的化学式为FeSO4×nH2O
n=7 ∴ 结晶水合物的化学式为FeSO4×7H2O (4)固体KNO3氧化性较弱,酸化后,实际就是稀HNO3表现氧化性,以氧化Fe2+。
|

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目
( 8分)已知氨水的电离度与醋酸的电离度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。
甲同学的解释是:Mg(OH)2(固)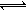 Mg2+(aq)+2OH—(aq)…………①
Mg2+(aq)+2OH—(aq)…………①
NH4++H2O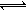 NH3·H2O +H+…………② H++OH―
NH3·H2O +H+…………② H++OH―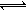 H2O…………③
H2O…………③
由于NH4+水解显酸性,H+与OH―反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是:Mg(OH)2(固)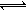 Mg2+(aq)+2OH—(aq)……① NH4++OH―
Mg2+(aq)+2OH—(aq)……① NH4++OH―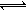 NH3·H2O……②
NH3·H2O……②
由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH―结合,生成了弱的电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是 (填写编号)。
| A.NH4NO3 | B.CH3COONH4 | C.Na2CO3 | D.NH3·H2O |
(3)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理 (填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。