题目内容
下列关于下图所示原电池装置的叙述中,正确的是
| A.铜片是负极 |
| B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 |
| D.氢离子在铜片表面被还原 |
D
解析试题分析:A、该原电池中Zn作负极,Cu作正极,错误;B、正极发生还原反应,所以Cu极有氢气放出,铜片质量不变,错误;C、外电路电流从正极流向负极,所以电流从锌片流向铜片,错误;D、氢离子在正极被还原,正确,答案选D。
考点:考查原电池反应原理的应用,正负极的判断,电流的流向,电极反应的判断

练习册系列答案
相关题目
下图为铁、铜水果电池装置示意图,下列说法正确的是
| A.铜片为负极 |
| B.铁片上发生还原反应 |
| C.该装置将电能转变为化学能 |
| D.电子由铁片沿导线流向铜极 |
下列对钢铁制品采取的措施不能防止或减缓钢铁腐蚀的是( )
| A.保持表面干燥 | B.表面镀锌 |
| C.表面镶嵌铜块 | D.与电源负极相连 |
银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是
| A.处理过程中银器一直保持恒重 |
| B.银器为正极,Ag2S被还原生成单质银 |
| C.该过程中总反应为2Al+3Ag2S═6Ag+Al2S3 |
| D.黑色褪去的原因是黑色Ag2S转化为白色AgCl |
我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4Al + 3O2 + 6H2O = 4Al(OH)3,下列说法不正确的是( )
| A.正极反应式为:O2 + 2H2O + 4e- = 4OH- |
| B.电池工作时,电流由铝电极沿导线流向铂电极 |
| C.以网状的铂为正极,可增大与氧气的接触面积 |
| D.该电池通常只需更换铝板就可继续使用 |
下列对如图所示装置实验判断的描述正确的是( )
| | a电极 | b电极 | X溶液 | 实验判断 |
| A | Cu | Zn | H2SO4 | H+向b极迁移 |
| B | Zn | Fe | H2SO4 | a、b极都放出无色气体 |
| C | Al | Mg | NaOH | a为负极,b为正极 |
| D | Cu | 石墨 | FeCl3 | a极质量减小,b极质量增加 |

储氢合金表面镀铜过程发生反应Cu2++2HCHO+4OH-=Cu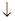 +H2
+H2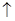 +2H2O+2HCOO-,下列说法错误的是
+2H2O+2HCOO-,下列说法错误的是
| A.电镀过程中氢气在镀件表面析出 |
| B.电镀时溶液中Cu2+移向阴极,并在阴极上发生还原反应 |
| C.阳极反应式为HCHO+3OH--2e-=2H2O+HCOO- |
| D.电镀时每生成6.4g铜镀层放出2.24L H2 |
下列反应能设计成原电池提供电能的是
| A.Cu与Cl2燃烧反应 | B.Ba(OH)2·8H2O与NH4Cl反应 |
| C.灼热的炭与CO2反应 | D.氢氧化钠溶液与稀盐酸反应 |
硫-钠原电池具有输出功率较高,循环寿命长等优点。其工作原理可表示为:2Na+xS Na2Sx。但工作温度过高是这种高性能电池的缺陷,科学家研究发现,采用多硫化合物(
Na2Sx。但工作温度过高是这种高性能电池的缺陷,科学家研究发现,采用多硫化合物(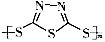 )作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性。下列有关叙述正确的是
)作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性。下列有关叙述正确的是
A.多硫化合物( )是一种新型无机非金属材料 )是一种新型无机非金属材料 |
B.多硫化合物(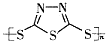 )化合物不能发生加成反应 )化合物不能发生加成反应 |
C.原电池的负极反应是将单体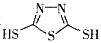 转化为 转化为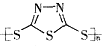 的过程 的过程 |
| D.当电路中有0.02mol电子通过时,原电池的负极将消耗原料0.46g |