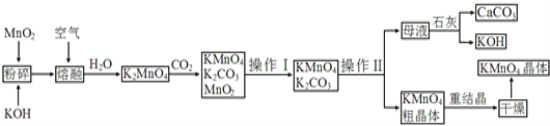
题目内容
【题目】下表是实验室制备气体的有关内容:
编号 | 实验内容 | 实验原理 |
① | 制氧气 | H2O2→O2 |
② | 制氨气 | NH4Cl→NH3 |
③ | 制氯气 | HCl→Cl2 |
(1)上述气体中:从制备过程看,必须选择合适的氧化剂才能实现的是_________(填气体的化学式,下同);从反应中有无电子转移的角度看,明显不同于其他气体的是______,写出实验室制取该气体的化学方程式_______________________________
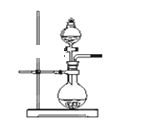
(2)若用上述装置制备NH3,则选择的试剂为____________________。
(3)制备Cl2需用8 mol/L的盐酸100mL,现用12 mol/L的盐酸来配制。
①需要12 mol/L的盐酸的体积为__________mL(精确到0.1 mL)
②在容量瓶的使用方法中,下列操作不正确的是_______________(填写标号)。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时用量筒量取浓盐酸后用玻璃棒引流入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用胶头滴管滴加蒸馏水直到凹液面的最低处和标线相平
D.定容后盖好瓶塞,用食指顶住,用另一只手手指托住瓶底,把容量瓶倒转和摇动多次
【答案】Cl2 NH3 Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O 浓氨水和生石灰(或氢氧化钠或碱石灰) 66.7mL BC
CaCl2+2NH3↑+2H2O 浓氨水和生石灰(或氢氧化钠或碱石灰) 66.7mL BC
【解析】
(1)反应①为分解反应,不需另加氧化剂;反应②为非氧化还原反应;反应③制备氯气的反应,HCl中的Cl化合价升高,HCl作还原剂,反应需要额外加入氧化剂,。答案为Cl2。
反应①、③为氧化还原反应,有电子转移;反应②为非氧化还原反应,无电子转移。明显不同于其他气体的是NH3。答案为NH3;
实验室用氯化铵和熟石灰反应制取氨气,反应的化学方程式为
Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O 答案为Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O 答案为Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(2)若用图中不需加热的装置制备NH3,可选择浓氨水和生石灰(或氢氧化钠或碱石灰),利用生石灰(或氢氧化钠或碱石灰)吸水放热的特点制备氨气。答案为:浓氨水和生石灰(或氢氧化钠或碱石灰);
(3) ①利用稀释前后溶液的物质的量相等建立等量关系式
需要12 mol/L的盐酸的体积为![]() 答案为66.7mL
答案为66.7mL
②A.使用容量瓶前检查它是否漏水,正确;
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗,必然产生误差,错误;
C.配制溶液时用量筒量取浓盐酸后用玻璃棒引流入容量瓶中,此操作错误,因为溶质必须放入烧杯内加水溶解,不能直接放入容量瓶内;
D.定容后盖好瓶塞,用食指顶住,用另一只手手指托住瓶底,把容量瓶倒转和摇动多次,正确;
故答案为BC。