题目内容
某元素X的相对原子质量为a,它的含氧酸化学式为HmXOn(m>1,为m元酸).下列有关说法中一定正确的是( )
| A、HmXOn 水溶液中n(H+):n(XOnm-)=m:1 | B、500mL 2mol?L-1的HmXOn溶液中溶质的质量是(m+a+16n)g | C、1L 0.1mol?L-1的HmXOn溶液正好中和0.1mol的KOH | D、若0.1mol?L-1的HmXOn溶液的pH=1,则0.1mol?L-1KmXOn溶液的pH>7 |
分析:A.根据HmXOn可能是多元弱酸解答;
B.根据n=cV计算HmXOn的物质的量,再根据m=nM计算溶质HmXOn的质量;
C.根据n=cV计算HmXOn的物质的量,根据反应本质OH-+H+═H2O计算判断;
D.若0.1mol?L-1的HmXOn溶液的pH=1,溶液中c(H+)=0.1mol/L<0.1m mol/L,故HmXOn为弱酸.
B.根据n=cV计算HmXOn的物质的量,再根据m=nM计算溶质HmXOn的质量;
C.根据n=cV计算HmXOn的物质的量,根据反应本质OH-+H+═H2O计算判断;
D.若0.1mol?L-1的HmXOn溶液的pH=1,溶液中c(H+)=0.1mol/L<0.1m mol/L,故HmXOn为弱酸.
解答:解:A.若HmXOn是多元弱酸,电离出的(XOnm-)很小,溶液中n(H+):n(XOnm-)远远大于m:1,且该酸不一定为m元酸,故A错误;
B.500mL 2mol?L-1的HmXOn溶液中HmXOn的物质的量为0.5L×2mol/L=1mol,溶质HmXOn的质量为1mol×(m+a+16n)g/mol=(m+a+16n)g,故B正确;
C.1L 0.1mol?L-1的HmXOn溶液中HmXOn的物质的量为1L×0.1mol/L=0.1mol,结合反应本质OH-+H+═H2O可知,中和氢氧化钾的物质的量为0.1mol×m=0.1m mol,故C错误;
D.若0.1mol?L-1的HmXOn溶液的pH=1,溶液中c(H+)=0.1mol/L<0.1m mol/L,故HmXOn为弱酸,0.1 mol?L-1KmXOn溶液中XOnm-离子水解,溶液呈碱性,故溶液的pH>7,故D正确;
故选:BD.
B.500mL 2mol?L-1的HmXOn溶液中HmXOn的物质的量为0.5L×2mol/L=1mol,溶质HmXOn的质量为1mol×(m+a+16n)g/mol=(m+a+16n)g,故B正确;
C.1L 0.1mol?L-1的HmXOn溶液中HmXOn的物质的量为1L×0.1mol/L=0.1mol,结合反应本质OH-+H+═H2O可知,中和氢氧化钾的物质的量为0.1mol×m=0.1m mol,故C错误;
D.若0.1mol?L-1的HmXOn溶液的pH=1,溶液中c(H+)=0.1mol/L<0.1m mol/L,故HmXOn为弱酸,0.1 mol?L-1KmXOn溶液中XOnm-离子水解,溶液呈碱性,故溶液的pH>7,故D正确;
故选:BD.
点评:本题考查常用化学计量的有关计算、弱电解质的电离、盐类水解等,难度中等,注意讨论酸的强弱进行解答.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目


 ,X可能的结构有
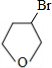
,X可能的结构有 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如:



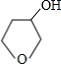 +NaBr
+NaBr
 ,X可能的结构有______种.
,X可能的结构有______种. )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如:
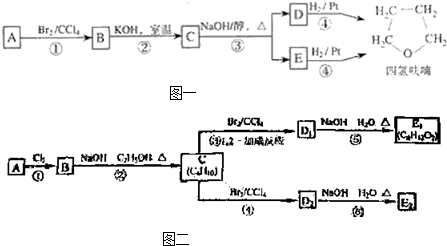
 R-O-R′+HX化合物A经下列四步反应可得到常用溶剂四氢 呋喃,反应框图如图一所示:
R-O-R′+HX化合物A经下列四步反应可得到常用溶剂四氢 呋喃,反应框图如图一所示: