题目内容
2011年3月11日,日本强地震导致两座核电站发生核泄漏,产生具有放射性的对人体和环境有害的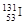 、
、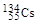 、
、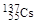 。下列有关叙述正确的是( )
。下列有关叙述正确的是( )
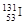 、
、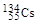 、
、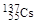 。下列有关叙述正确的是( )
。下列有关叙述正确的是( )A.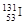 和 和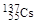 位于同一周期 位于同一周期 |
B.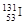 和 和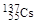 具有相同的中子数 具有相同的中子数 |
C.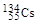 原子半径小于 原子半径小于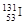 原子半径 原子半径 |
| D.Cs元素最高价氧化物对应的水化物呈强碱性 |
D
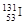 是第五周期
是第五周期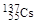 第六周期,半径I<Cs。
第六周期,半径I<Cs。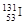 的中子数为78,
的中子数为78,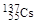 的中子数82.ABC错误。 Cs元素为金属元素,最高价氧化物对应的水化物呈强碱性。
的中子数82.ABC错误。 Cs元素为金属元素,最高价氧化物对应的水化物呈强碱性。
练习册系列答案
相关题目
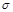 键数目为 。
键数目为 。
